УРАВНЕНИЕ СОСТОЯНИЯ
Для равновесной термодинамической системы существует функциональная связь между параметрами состояния, которая называется уравнением состояния. Опыт показывает, что удельный объем, температура и давление простейших систем, которыми являются газы, пары или жидкости, связаны термическим уравнением состояния вида f(р,v,T) = 0.
Уравнению состояния можно придать другую форму:
р = f1(V,T); V = f2(р,Т), T = f3(P,V); [10]
Эти уравнения показывают, что из трех основных параметров, определяющих состояние системы, независимыми являются два любых.
Для решения задач методами термодинамики совершенно необходимо знать уравнение состояния. Конкретный вид уравнения состояния зависит от индивидуальных свойств вещества.Основные законы идеальных газов
Идеальными газами называют такие, которые полностью подчиняются законам Бойля-Мариотта и Гей-Люссака. В идеальных газах отсутствуют силы взаимного притяжения и отталкивания между молекулами, а объем самих молекул пренебрежимо мал по сравнению с объемом газа.
Все реальные газы при высоких температурах и малых давлениях почти полностью подходят под понятие «идеальный газ» и практически по свойствам не отличаются от него. Состояние идеального газа — это предельное состояние реального газа, когда давление стремится к нулю (р→ 0).
Введение понятия об идеальном газе позволило составить простые математические зависимости между величинами, характеризующими состояние тела, и на основе законов для идеальных газов создать стройную теорию термодинамических процессов.
Закон Бойля-Мариотта устанавливает зависимость между удельным объемом и абсолютным давлением идеального газа в процессе при постоянной температуре. Этот закон был открыт опытным путем английским физиком Бойлем в 1664 г. и не в зависимости от него французским химиком Мариоттом в 1676 г.
Закон Бойля-Мариотта гласит: при постоянной температуре объем, занимаемый идеальным газом, изменяется обратно пропорционально его давлению: 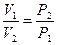
Или при постоянной температуре произведение удельного объема на давление есть величина постоянная: P1V1 = P2V2 = const
Графически в системе координат PV закон Бойля - Мариотта изображается равнобокой гиперболой. Эта кривая получила название изотермы, а процесс, протекающий при постоянной температуре, — изотермным (изотермическим).
Закон Гей-Люссака устанавливает зависимость между удельным объемом и абсолютной температурой при постоянном давлении. Этот закон был открыт экспериментальным путем французским физиком Жозефом Луи Гей-Люссаком в 1802 г.
Закон Гей-Люссака гласит: при постоянном давлении объемы одного и того же количества идеального газа изменяются прямо пропорционально абсолютным температурам: 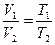
В системе координат PV закон Гей-Люссака изображается прямой, параллельной оси абсцисс. Эту прямую называют изобарой, а сам процесс — изобарным или процессом, протекающим при постоянном давлении.
Дата добавления: 2015-08-14; просмотров: 1847;
