Сложные эфиры.
1) Сложные эфиры – _________________________________________________________________.
Сложные эфиры – __________________________________________________________________
__________________________________________________________________________________
__________________________________________________________________________________:
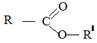 , где R и R/ - _____________________________, которые могут быть как одинаковыми, так и различными.
, где R и R/ - _____________________________, которые могут быть как одинаковыми, так и различными.
Функциональная группа сложных эфиров называется __________________________:
 . Молекулярный состав сложных эфиров выражает общая формула C- H—O--.
. Молекулярный состав сложных эфиров выражает общая формула C- H—O--.
2) Этиловый эфир уксусной кислоты как представитель сложных эфиров.
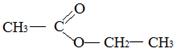
3) Номенклатура и изомерия сложных эфиров
* При названии сложных эфиров по правилам заместительной номенклатуры ИЮПАК сначала указывают название алкильной группы спирта, а затем название кислотного остатка, заменяя в названии кислоты суффикс –овая на суффикс –оат.
 этилэтаноат
этилэтаноат
2- остаток 1-алкильная группа
кислоты спирта
* Структурная изомерия
- внутри класса – изомерия цепи:
Молекулярной формуле С4Н8О2 соответствуют следующие изомеры:

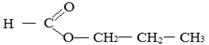
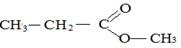
Этилэтаноат Пропилметаноат Метилпропаноат
- межклассовая изомерия:

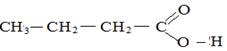
Этилэтаноат Бутановая кислота
4) Гидролиз сложных эфиров
o Кислотный:
 + Н2О
+ Н2О 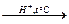
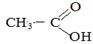 + СН3—СН2—ОН
+ СН3—СН2—ОН
_______________ _____________ ________
o Щелочной:
 + NaOH
+ NaOH 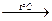
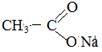 + СН3—СН2—ОН
+ СН3—СН2—ОН
______________ ______________ _________ ______________
5) Эфиры в природе.
Многие сложные эфиры в природе содержатся в клеточном соке цветков и плодов растений.
Жиры.
1) Состав и строение триглицеридов.
Жиры –____________________________________________________________________________.
Основным компонентом жиров являются _________________ –_____________________________
____________________________________________________________________________________.
Схема, отражающая общее строение триглицеридов:
 , где R1, R2, R3 – остатки карбоновых кислот (____________ СН3СН2СН2СООН , ________________ С15Н31СООН, _____________ С17Н35СООН , ________________ С17Н33СООН, ___________________С17Н31СООН, ________________________ С17Н29СООН.
, где R1, R2, R3 – остатки карбоновых кислот (____________ СН3СН2СН2СООН , ________________ С15Н31СООН, _____________ С17Н35СООН , ________________ С17Н33СООН, ___________________С17Н31СООН, ________________________ С17Н29СООН.
2) Физические свойства.
| 1. Агрегатное состояние | - _______________ (преобладают в составе молекулы остатки ненасыщенных карбоновых кислот: олеиновой, линолевой, линоленовой); - _______________ (преобладают в составе молекулы остатки насыщенных карбоновых кисло:т: масляной, пальмитиновой, стеариновой). |
| 2. Плотность относительно воды | - _______________, чем воды. |
| 3. Растворимость: - в воде – - в органических растворителях – | - _______________________; - _________________________ в бензоле, бензины, дихлорэтане, частично в этаноле. |
| 4. tплавл. | - с ____________ содержания остатков насыщенных карбоновых кислот и _________________ длины УВ цепи ________________. |
3) Жиры как питательные вещества.
Жиры являются важной составляющей частью пищи человека и животных. В организме в процессе гидролиза жиры расщепляются на глицерин и высшие карбоновые кислоты. Затем внутри клеток из продуктов гидролиза синтезируются специфические для данного организма жиры.
Жиры являются важнейшим источником энергии: в результате их окисления вырабатывается в два раза больше энергии, чем при окислении углеводов.
Домашнее задание: §§39-40, 42.
1.Составьте уравнения реакций, при помощи которых можно осуществить следующие превращения: С2Н6® С2Н6® С2Н5ОН® СН3СООН®СН3СОО С2Н5
2. Составьте структурные формулы всех возможных изомеров состава С5Н10О2 и дайте им названия по правилам заместительной номенклатуры ИЮПАК.
Лекции 20, 21 Углеводороды: алканы, алкены, алкены, арены.
 Названия
гомологических
рядов
Характеристика Названия
гомологических
рядов
Характеристика
| Алканы | Алкены | Алкины | Арены | ||
| 1. Определение | Ациклические насыщенные УВ, в молекулах которых атомы углерода между собой связаны только одинарными (простыми) связями | Ациклические ненасыщенные УВ, в молекулах которых 2 атома углерода связаны двойной связью | Ациклические ненасыщенные УВ, в молекулах которых 2 атома углерода связаны тройной связью | Циклические ненасыщенные УВ, в молекулах которых имеется одно или несколько бензольных колец | ||
| 2. Общая формула | CnH2n+2 | CnH2n | CnH2n-2 | CnH2n-6 | ||
| 3. Простейший представитель | метан | этен | этин | бензол | ||
| а) Молекулярная формула | CH4 | C2H4 | C2H2 | C6H6 | ||
б)  Структурная формула Структурная формула
| H ½ H¾C¾H ½ H | H H \ / C═C / \ H H | H¾CºC¾H | 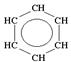
| ||
| в) Электронная формула | 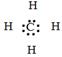
| 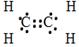
| 
| 

| ||
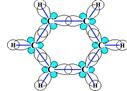
4.  Пространственное строение молекулы:
а) Форма Пространственное строение молекулы:
а) Форма
| Метан - тетраэдрическая
Гомологи метана, начиная с бутана – зигзагообразная
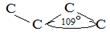
| В области двойной связи - плоская | В области тройной связи – цилиндрическая (линейная) | Плоская | ||
| б) Угол связи | 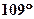
| 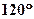
| 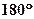
| 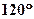
| ||
| в) Характер связи | одинарная | двойная | тройная | Ароматическая | ||
| г) Длина связи | 0,154 нм | 0,133 нм | 0,120 нм | 0,140 нм | ||
| 5. Возможность вращения атомов углерода относительно друг друга в зависимости от характера связи | Относительно свободно | Относительно двойной связи затруднено (невозможно без разрыва двойной связи) | Относительно тройной связи затруднено (невозможно без разрыва тройной связи) | Между атомами углерода бензольного кольца затруднено (невозможно без разрыва бензольного кольца) | ||
| 6. Тривиальные названия | С1 метан, С2 этан, С3 пропан, С4 бутан (окончание –ан, относят к полусистематическим) | СН2=СН2 этилен, СН2=СН– СН3 пропилен СН2=СН– СН2– СН3 бутилен | СНºСН ацетилен | С6С6 бензол | ||
| 7. Изомерия – | явление существования соединений, имеющих одинаковый качественный и количественный состав, но различное химическое строение (различный порядок соединения атомов в молекуле); для УВ бывает структурной (цепи; положения кратной связи) и пространственной. | |||||
| Структурная | Изомерия цепи | СН3 – СН2– СН2– СН3 tкип= - 0,5°С СН3 – СН– СН3 ï СН3 tкип= -1 0,2°С | СН2=СН– СН2– СН3 бутен-1 СН2 = С– СН3 ï СН3 2-метилпропен | СНºС– СН2–СН2– СН3 пентин-1 СНºС – СН–– СН3 ï СН3 3-метилбугин-1 | - | |
| Изомерия положения кратной связи | - | СН2=СН– СН2– СН3 бутен-1 СН3–СН= СН– СН3 бутен-2 | СНºС – СН2– СН3 бутин-1 СН3–Сº С– СН3 бутин-2 | - | ||
| Пространственная – цис-транс-изомерия | - | Н3С Н \ ¤ С=С ¤ \ Н3С Н цис-изомер | Н СН3 \ ¤ С=С ¤ \ Н3С Н транс-изомер | - | - | |
| Физические свойства | ||||||
| 1. агрегатное состояние: | С1-С4 –_____, С5-С15 – ________, с С16 – ________________________; | С2-С4 –______, С5-С17 –______ , с С18 – ___________________; | С2-С4 – _____, С5-С16 –_______, с С17 – ___________________; | жидкость (бесцветная, сильно преломляющая, с характерным запахом) | ||
| 2. tкип. и tплав. | с увеличением Мr возрастают tкип. и tплав. | с увеличением Мr возрастают tкип | с увеличением Мr возрастают tкип | tкип.= 80,1°С, tплав.=5,5°С | ||
| 3. растворимость в воде | практически не растворимы | практически не растворимы | практически не растворимы | не растворим | ||
| 4. физиологическое воздействие на организм | - | - | - | высоко токсичное соединение | ||
| Химические свойства | ||||||
| Реакции окисления: - полное окисление (горение) - неполное окисление | СН4+2О2→______+____+Q Смеси метана с кислородом (1:2 по объему) и с воздухом (1:10) взрывоопасны 2СН4+3О2→ | С2Н4+_О2→
С2Н4+{О}+ Н2О  ®
этиленгликоль
®
этиленгликоль
| _С2Н2+_О2→ | _С6Н6+__О2→ | ||
| Реакции замещения (при освещении с хлором и бромом) | 1) CH4+Cl2 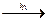 CH3―CH3 + Cl2
CH3―CH3 + Cl2 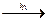 →
2) В процессе галогенирования метана происходит последовательное замещение всех атомов водорода и образуется смесь продуктов: CH4 →
2) В процессе галогенирования метана происходит последовательное замещение всех атомов водорода и образуется смесь продуктов: CH4  CH3Cl CH3Cl  метан хлорметан
→CH2Cl2
метан хлорметан
→CH2Cl2  CHCl3 CHCl3  дихлорметан трихлорметан (хло-
→ CCl4 роформ)
тетрахлорметан (четыреххлористый углерод)
Растворитель, тяжелая негорючая жидкость – пожаротушение, получают полным хлорированием метана:
CH4+4Cl2
дихлорметан трихлорметан (хло-
→ CCl4 роформ)
тетрахлорметан (четыреххлористый углерод)
Растворитель, тяжелая негорючая жидкость – пожаротушение, получают полным хлорированием метана:
CH4+4Cl2 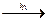 3) взаимодействие других алканов приводит к образованию смеси изомеров:
CH3― CH2―CH3 + 2Cl2
3) взаимодействие других алканов приводит к образованию смеси изомеров:
CH3― CH2―CH3 + 2Cl2 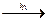 →CH3― CH2― CH2Cl +
+ CH3―CHCl― CH3 + 2HCl →CH3― CH2― CH2Cl +
+ CH3―CHCl― CH3 + 2HCl
| - | - | Н 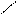 
 +Br2 +Br2 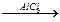 галогенирование
галогенирование
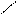  Н Н
 +HONO2 +HONO2 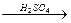 ®
нитрование
®
нитрование
| ||
| Пиролиз | С2Н6 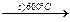 СН2=СН2 + Н2 СН2=СН2 + Н2
| - | - | - | ||
| Изомеризация | СН3– СН2– СН2– СН3 ® 
| - | - | - | ||
| Реакции присоединения: -галогенов | - | СН2=СН2+Br2 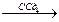 ®
обесцвечивание бромной воды (или раствора брома в тетрахлорэтане) – качественная реакция на УВ с двойной связью
®
обесцвечивание бромной воды (или раствора брома в тетрахлорэтане) – качественная реакция на УВ с двойной связью
| СНºСН +Br2 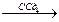 ®
BrСН= СНBr +Br2
®
BrСН= СНBr +Br2 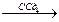 ®
®
| - | ||
| - водорода (гидрирование) | - | СН2=СН2+Н2  ®
®
| СНºСН 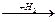 ________® ________® 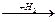
| 
 +3Н2 +3Н2 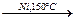 бензол циклогексан
бензол циклогексан
| ||
| - воды (гидратация) | - | СН2=СН2+Н2О  ®
®
| СНºСН + Н2О 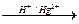 ® ®
| - | ||
| - галогеноводоролов | - | СН2=СН2+НCl ® | СНºСН + 2НCl ® | - | ||
| Реакция полимкризации (синтез ВМС из низкомолекулярных соединений; НМС – мономер, ВМС - полимер) | - | nСН2=СН2® | тримеризация
3 СНºСН 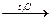
| - | ||
В основе названия углеводородов по систематической заместительной номенклатуре лежат принципы отраженные в схеме:
|
|
|
+ + +
 |  | ||||||
 |  | ||||||



|
|
|
|
|

 Не для УВ
Не для УВ
алканы алканы алкены алкины
2. Название насыщенных углеводородов, которые берутся для основы названия всех остальных органических соединений (корни греческих числительных выделены):
Таблица 1.
| Число атомов С | Название | Число атомов С | Название | Число атомов С | Название |
| С1 | Метан | С7 | Гептан | С13 | Тридекан |
| С2 | Этан | С8 | Октан | С20 | Эйкозан |
| С3 | Пропан | С9 | Нонан | С21 | Генэйкозан |
| С4 | Бутан | С10 | Декан | С22 | Докозан |
| С5 | Пентан | С11 | Ундекан | С30 | Триаконтан |
| С6 | Гексан | С12 | Додекан | С40 | Тетраконтан |
Таблица 2.Название греческих числительных,
при помощи которых указывается
число одинаковых заместителей Таблица 3. Названия заместителей
| Число заместителей | Греческое числительное | Число заместителей | Греческое числительное | Заместитель | Название |
| 2 | ди- | 7 | гепта- | СН3 - | Cl - |
| 3 | три- | 8 | окта- | С2Н5 - | Br - |
| 4 | тетра- | 9 | нона- | С3Н7 - | I - |
| 5 | пента- | 10 | дека- | F - | NH2 - |
| 6 | гекса- |
3) Последовательность действий при составлении названий органических углеводородов и их производных.
A. Названия углеводородов с неразветвленной цепью.
1. Названия алканов приведены в таблице 1.
2. В основу названий алкенов и алкинов положены названия алканов, в которых суффикс –ан заменен соответственно на суффикс –ен или суффикс –ин. В конце указываем арабской цифрой положение кратной связи.
B. Названия углеводородов с разветвленной цепью.
1. Находим главную цепь:
1) Самая длинная,
2) Включает двойную, тройную связь,
3) Включает такие заместители, как F -, Cl -, Br -, I -.
2. Нумеруем с того конца, к которому ближе
1)  Заместитель
Заместитель
2) Двойная связь приоритет возрастает
3)  Тройная связь сверху вниз
Тройная связь сверху вниз
4) В алфавитном порядке указываем при помощи арабских цифр положение заместителей (названия см. в таблице 3).
5) Предпочтение отдаем варианту, в котором первая отличающаяся цифра наименьшая.
6) При помощи приставки (см. таблицу 2) указываем число одинаковых заместителей.
7) Добавляем название главной цепи в соответствии с числом атомов углерода, содержащихся в ней (см. выделенные корни в таблице 1)
8) В случае алкенов и алкинов в конце названия прибавляем соответствующий суффикс –ен или –ин.
9) Указываем арабской цифрой положение кратной связи (предпочтение отдаем варианту, в котором цифра наименьшая).
C. Между цифрой и буквой ставим дефис, между цифрами – запятую. Основой названия ароматических углеводородов является название простейшего представителя – бензола.

 СН3
СН3

метилбензол
Дата добавления: 2015-08-14; просмотров: 3272;
