Физико-химические и токсические свойства фосфорорганических соединений
Фосфорорганические соединения нашли применение как инсектициды (хлорофос, карбофос и др.), лекарственные препараты (фосфакол, армин и т.д.). Наиболее токсичные представители группы приняты на вооружение армий целого ряда стран в качестве боевых отравляющих веществ (зарин, зоман, Vx). Поражение ФОС людей возможно при авариях на объектах по их производству, при применении в качестве ОВ или диверсионных агентов.
Впервые ФОС были синтезированы Тенаром в 1846 г. В нашей стране основоположником химии ФОС был А.Е. Арбузов, предложивший в 1905 г. новый метод их синтеза. На токсические свойства этих соединений внимание было обращено только в 1932 г., когда Ланге и Крюгер впервые описали симптомы отравления диметил- и диэтилфторфосфатом, синтезированными в процессе поиска новых инсектицидов. Бесспорная практическая значимость таких средств явилась причиной масштабных исследований, направленных на всестороннее изучение нового класса биологически активных веществ. Так, за короткий промежуток времени только в Германии, в лаборатории Шрадера, с целью изыскания все новых средств борьбы с вредными насекомыми было синтезировано и изучено более 2000 ФОС, среди которых многие обладали высокой токсичностью и для млекопитающих. Это послужило поводом для создания на их основе новых образцов химического оружия. К началу второй мировой войны химиками Германии были синтезированы такие высокотоксичные отравляющие вещества, как табун, зарин, несколько позже – зоман. Одновременно были определены перспективы изыскания еще более токсичных для человека соединений, что на практике было реализовано Таммелином (1955), синтезировавшим метилфторфосфорилхолин, явившийся прообразом новой группы ФОВ, обозначаемых как V-газы (Vх). В 70 – 80-х гг. ХХ столетия была разработана технология применение ФОВ в так называемых бинарных боеприпасах. При этом два относительно мало ядовитых химических соединения хранятся, транспортируются и размещаются в боеприпасах раздельно. Компоненты смешиваются лишь после выстрела и образуют на пути к цели в ходе химической реакции высокоядовитое ОВ. Чрезвычайно высокая токсичность и особенности физико-химических свойств, позволяющие быстро создавать обширные очаги химического заражения, до недавнего времени делали ФОВ (зарин, зоман, V-газы) наиболее опасными из всех известных ОВ. В соответствии с международными договоренностями, запасы ФОВ в большинстве стран мира подлежат уничтожению.
В настоящее время исследования в области создания все новых биологически активных веществ на основе ФОС продолжаются.
ФОС – производные кислот пятивалентного фосфора. Все токсичные соединения фосфорной (1), алкилфосфоновой (2) и диалкилфосфиновой (3) кислот имеют структуру:
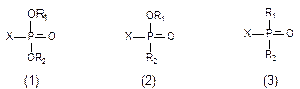
Фосфор с помощью двойной связи соединен с атомом кислорода или серы; двумя связями - с алкил-, алкокси- арил-, моно- или диалкиламиногруппами и т.д. (R1, R2); пятая (Х) - насыщена группой, относительно легко отщепляющейся от атома фосфора (F-, CN-, -ОR, -SR и т.д.). За счет высвобождающейся при этом валентности, ФОС и взаимодействует с активными центрами ряда энзимов.
Структурные формулы некоторых ФОС представлены на рис. 1.
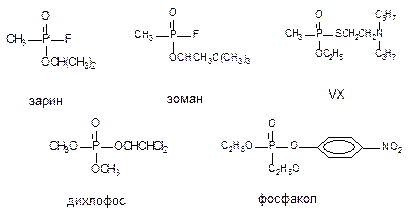
Рис. 1. Структуры некоторых фосфорорганических соединений
Все ФОС обладают высокой реакционной способностью. Особое значение придают реакциям фосфорилирования, гидролиза и окисления, поскольку именно эти реакции определяют стойкость токсикантов в окружающей среде, имеют отношение к метаболизму и механизму токсического действия ядов в организме, на них основаны некоторые принципы дегазации, обнаружения, антидотной профилактики и терапии интоксикаций.
ФОС при взаимодействии с водой подвергаются гидролизу с образованием нетоксичных продуктов. Скорость гидролиза ФОС, растворенных в воде, различна (например, зарин гидролизуется быстрее, чем зоман, а зоман – быстрее, чем V-газы).
В результате реакции окисления, ФОС также разрушаются, однако в ряде случаев (при окислении фосфотионатов до фосфатов) некоторые вещества даже повышают свою активность. Это иллюстрируется примером
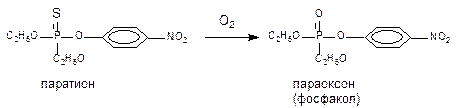
Токсичность параоксона для человека выше, чем паратиона.
Важнейшие свойства фосфорорганических отравляющих веществ представлены в табл. 3-5.
Таблица 3
Дата добавления: 2015-08-14; просмотров: 979;
