Аминокислоты. Тема 1. Строение и функции белков
Тема 1. Строение и функции белков
На долю белков в клетке приходится не менее половины сухого веса клетки. Белки выполняют разные функции, но не могут делать одно – синтезировать сами себя (для их биосинтеза необходима макромолекулярная матрица – мРНК). Строительными блоками (мономерами) любого белка являются небольшие биомолекулы – аминокислоты. Первая аминокислота (аспарагин) была открыта в 1806 г., а последняя из 20 стандартных аминокислот (треонин) – в 1938 г.
Все аминокислоты имеют карбоксильные группы, аминогруппы, связанные с асимметрическим атомом углерода (его называют хиральным центром). Различаются аминокислоты лишь боковыми цепями (R- группами, радикалами), которые у разных аминокислот не одинаковые по структуре и свойствам, что определяет их молекулярные массы. Как правило, аминокислоты имеют трехбуквенные условные обозначения:
Алифатические
Глицин
Аланин
Валин
Лейцин
Изолейцин | Гли Ала Вал Лей Иле | H CH3 СН3 CH СН3 СН3 СН2 СН СН3 СН3 СН СН2 СН3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Гидроксиаминокислоты | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
     Серин
Треонин
Серин
Треонин
| Сер Тре | СН2 ОН СН СН3 ОН | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Дикарбоксильные | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
  Аспарагиновая
кислота
Глутаминовая
кислота
Аспарагиновая
кислота
Глутаминовая
кислота
| Асп Глу | СН2 СООН СН2 СН2 СООН | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
   Амиды дикарбоксильных аминокислот Амиды дикарбоксильных аминокислот
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
     Аспарагин
Глутамин
Аспарагин
Глутамин
| Асн Глн | СН2 СОNН2 СН2 СН2 СОNН2 |
| Аминокислоты с катионообразующими группами в боковых цепях | ||||||
             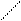      Гистидин
Лизин
Аргинин
Гистидин
Лизин
Аргинин
| Гис Лиз Арг | СН2 HN N CH СН2 СН2 СН2 СН2 │ NH2 (СН2)2 HN C NH2 NH | ||||
| Серосодержащие аминокислоты | ||||||
    Цистеин
Метионин
Цистеин
Метионин
| Цис Мет | ― СН2 ― SH СН2 СН2 SH СН3 | ||||
| Ароматические аминокислоты | ||||||
               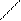   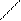    Фенилаланин
Тирозин
Фенилаланин
Тирозин
| Фен Тир |
CH2
CH2 OH | ||||
          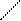 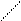     Триптофан
Триптофан
| Три | СН2 N H | ||||
| Иминокислота | ||||||
  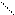    Пролин
Пролин
| Про | COOH N H | ||||
17 из 20 аминокислот имеют по 1 хиральному центру и поэтому могут быть представлены в белках в виде L- или D-стереоизомеров (чаще L– изомеры). Треонин и изолейцин имеют 2 хиральных центра и, следовательно, они имеют 2n=22=4 стереоизомера. Глицин, у которого радикал представляет собой атом водорода, то есть он не содержит асимметрические атомы углерода, вовсе не имеет стереоизомеров.
Кроме только что описанной классификации аминокислот (на L- и D- формы), существуют и другие классификации.
Так, аминокислоты можно разделить на группы в зависимости от свойств радикалов аминокислот: 1) неполярные (гидрофобные аминокислоты) R-группы (аланин, валин, изолейцин, лейцин, метионин, пролин, триптофан, фенилаланин); 2) полярные, но не заряженные R-группы (аспарагин, глицин, глутамин, серин, тирозин, треонин, цистеин); 3) отрицательно заряженные R-группы (аспарагиновая кислота, глутаминовая кислота); 4) положительно заряженные R-группы (аргинин, гистидин, лизин).
Для наименования аминокислот, как правило, применяют тривиальные названия, поскольку в соответствии с международной классификацией (IUPAC), их названия весьма громоздки и формируются, как у карбоновых кислот вообще, с перечислением имеющихся в углеродной цепи заместителей. Например, аминокислоты лизин и серин, имеющие строение:
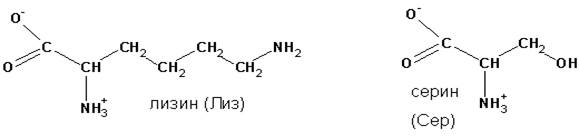
|
будут называться, соответственно - 2,6-диаминогексановая (лизин), и - 2-амино-3-гидроксипропановая кислота (серин).
Поскольку белки состоят из аминокислот, то они тоже могут быть (в зависимости от содержания тех или иных аминокислот) гидрофобными, гидрофильными, несущими преимущественно положительный или отрицательный заряды. Перечисленные выше свойства белков имеют огромное значение для выполнения присущих им функций. Особенно это важно для ферментов, гормонов и других регуляторных белков.
Аминокислота цистеин, имеющая в R-группе атом серы, способна с такой же молекулой образовывать прочную, ковалентную дисульфидную связь (S―S- мостик):
Дата добавления: 2015-08-14; просмотров: 1444;