СООН СООН
│ │
H2N―С―Н H2N―С―Н
│ │
СН2 ― S ― S ― CH2
Цистин
Цистеин играет важную роль в формировании таких белков, как инсулин, иммуноглобулины, α-кератин волос и шерсти, фибриноген шелка, коллаген сухожилий, некоторые токсины (например, яды змей, скорпионов, морских беспозвоночных). Прочная ковалентная S―S-связь определяет прочность, свойства и особенности строения перечисленных выше белков.
20 аминокислот, структурные формулы и названия которых представлены выше, называются протеиногенными, поскольку они превалируют в составе большинства природных белков. Однако некоторые белки живых организмов содержат так называемые небелковые или редковстречающиеся аминокислоты. К числу таких аминокислот относятся:
1) оксилизин (его много в коллагене)
NH2-CH2-CH(OH)-(CH2)2-CH(NH2)-COOH;
2) a,g-диаминопимелиновая кислота (только у бактерий)
HOOC-CH(NH2)-(CH2)3-CH(NH2)-COOH;
3) a-аминоадипиновая кислота (в белке зерна кукурузы)
HOOC-(CH2)3-CH(NH2)-COOH;
4) b-аланин
NH2-(CH2)2-COOH;
5) орнитин
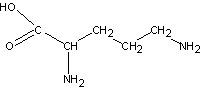
6) цитруллин
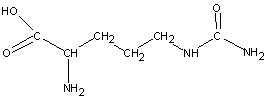
7) g-аминомасляная кислота
NH2-(CH2)3-COOH
Аминокислоты обладают уникальным свойством, определяющим исключительно важные свойства белков - их амфотерность. α–Аминокислоты, содержащие одну аминогруппу и одну карбоксильную группу, кристаллизуются из нейтральных водных растворов (рН=7,0) в виде полностью биполярных ионов (цвиттерионов). Такие молекулы имеют суммарный заряд, равный нулю. Но в зависимости от рН среды, аминокислоты могут выступать в роли либо кислот (доноров протонов), либо в роли оснований (акцепторов протонов), то есть являться амфолитами (амфотерными соединениями):
Н Н+ Н Н+ н
│ ↑ │ ↑ │
R―C―COOH → R―C―COO- → R―C―COO-
│ │ │
+ NH3 + NH3 NH2
рН<7,0 рН =7,0 рН>7,0
Амфотерные свойства присущи большинству белков и определяют многие их функции и возможность взаимодействия белков с другими как органическими, так и неорганическими молекулами.
Белки
Аминокислоты способны вступать в реакции поликонденсации, формируя при этом полипептидные молекулы, аминокислотные остатки в которых, соединены пептидными связями:
H O R2
│ ║ │
H2N―Cα―C―OH + H―N―Cα ―COOH
│ │ │
R1 H H
↓→ H2O
H O R2
│ ║ │
H2N―Cα ―C―N―Cα ―COOH
│ │ │
R1 H H
O
║
Группировка (―C―N―) называется пептидной группой, а связь, С―N в
│
H
этой группировке называется пептидной связью. Поскольку связь, С―N короче других связей в полипептидной цепи, то вращение вокруг этой связи практически невозможно. Связи Сα―С и N―Сα длиннее пептидной и поэтому относительно них возможны повороты участков полипептидной цепи (длина С―N-связи равна 0,132 нм, Сα ―С – 0,153 нм, N―Cα – 0,147 нм).
За счет поворотов полипептидной цепи относительно, Сα―Ν и N―Сα–связей, белковая молекула может приобретать различные конформации в пространстве.
Известно четыре вида пространственных конформаций полипептидных молекул:первичная, вторичная, третичная и четвертичная структуры.
Первичная структура - это качественный и количественный состав, а также последовательность аминокислот в молекуле белка. Она определяет все последующие возможные уровни организации белков, а также их функции. Порой замена лишь одной из многих аминокислот в молекуле белка приводит к серьезным нарушениям функций всей белковой молекулы. Доказательством вышесказанного служит наследственное заболевание – серповидноклеточная анемия.
В крови больных этим заболеванием эритроциты представляют собой серповидные клетки. Необычная форма эритроцитов у таких больных обусловлена присутствием в эритроцитах аномального гемоглобина (гемоглобин S). Молекулы такого S-гемоглобина склонны к агрегации, они хуже связывают кислород, и у больных наблюдается анемия, то есть возникают приступы резкой слабости, тошноты и одышки, появляется тахикардия.
Столь серьезные и важные для жизни человека свойства S-гемоглобина определяются тем, что в шестом положении β-цепи гемоглобина вместо глутаминовой кислоты находится валин. Таким образом, очевидно, что замена одного из 574 аминокислотных остатков в молекуле гемоглобина приводит к жизненно важным изменениям в функционировании гемоглобина и, как следствие, всего организма в целом.
Представляющие собой цепочки молекул белков – явление крайне редкое. Как правило, полипептиды уложены в пространстве очень сложно: в виде клубков, фибриллярных тяжей, эллипсоидов и так далее. Единственная конформация белковой молекулы, в которой она может существовать и функционирует в естественном состоянии, называется нативной конформацией, а сам белок – нативным белком.
Следующим за первичной структурой белка, следует вторичная структура. Она может быть представлена α-спиралью, β-конформацией, β- изгибом, аморфными участками. Белки с одинаковой молекулярной массой, но с разным качественным составом аминокислот, будут иметь преимущественно только один вид вторичной структуры. В природе встречаются белки, у которых α-спиральные участки чередуются с β-слоями, β-изгибами и аморфными участками.
Таким образом, под термином вторичная структура понимают пространственное расположение, то есть конформацию, соседних аминокислотных остатков в полипептидной цепи.
В полипептидных цепях нативных α-кератинов аминокислотный состав и последовательность аминокислот благоприятствуют самопроизвольному образованию α-спирали с множеством стабилизирующих ее внутримолекулярных водородных связей. Волосы и шерсть состоят из множества фибрилл, каждая фибрилла в свою очередь состоит из многих еще более тонких нитей, навитых друг на друга наподобие каната.
Основным элементом структуры волоса служит полипептидная цепь α-кератина в нативной α-спиральной конформации. Три α-спиральные цепи образуют скрученный (суперспирализованный) трехтяжный «канат». Одиннадцать таких канатов составляют микрофибриллу волоса.
Фиброин шелка состоит из β-кератинов, имеющих типичную β-структуру. В фиброине зигзагообразные полипептидные цепи уложены параллельно друг другу в виде целого ряда складок. Поэтому такая структура называется складчатым слоем. Для β-конформации характерно отсутствие внутрицепочечных водородных связей, а вместо них образуется межцепочечная водородная связь между пептидными группами соседних полипептидных цепей, находящихся в вытянутой конформации.
Еще одним белком, имеющим вторичную структуру, является самый распространенный белок у высших животных – коллаген. На долю коллагена приходится примерно 1/3 всей массы белков позвоночных. Чем крупнее животное, тем большую часть всего белка составляет коллаген. Тело коровы, весящей 400 кг, скрепляется и поддерживается в основном системой прочных коллагеновых волокон, находящихся в коже, сухожилиях, хрящах и костях животных.
Коллагеновая соединительная ткань состоит из волокон, которые в свою очередь состоят из коллагеновых фибрилл. Фибриллы коллагена могут выдержать нагрузку, вес которой, по меньшей мере, в 10 000 раз превышает их собственный вес, то есть по прочности они превосходят стальную проволоку равного поперечного сечения.
Кроме фибрилльных белков, в природе в бóльшем количестве встречаются глобулярные белки. Такие белки значительно более сложные по конформации и способны выполнять самые разнообразные функции. Нативная свернутая конформация глобулярных белков служит обязательным условием для выполнения свойственных этим белкам биологических функций. То есть все глобулярные белки компактно свернуты специфическим образом, благодаря чему и возникает их биологическая активность.
Способ свертывания полипептидных цепей глобулярных белков в компактную сферическую глобулу называют третичной структурой.
Глобулярные белки различных типов имеют не одинаковую структуру: в миоглобине 80% молекулы представлено α-спиральными сегментами; в цитохроме с – 40% молекулы имеют α-спирализацию, в рибонуклеазе содержится очень мало α-спиральных участков, а β-конформация составляет около 80% всей молекулы.
Третичная структура глобулярных белков обусловлена аминокислотной последовательностью (и близко, и далеко расположенных аминокислот). Образование изгибов полипептидной цепи, а также направление и угол поворота цепи в этих изгибах обусловлены числом и положением определенных аминокислотных остатков (например, пролина, треонина, серина), которые способствуют образованию изгибов.
Одним из убедительных доказательств того, что третичная структура глобулярных белков определяется его аминокислотной последовательностью, является способность некоторых белков ренатурировать после денатурации. Денатурацией называется процесс изменения нативной конформации белков под действием различных факторов (рН, tо, давления, концентрированные соли, тяжелые металлы и пр.). Так, если подействовать на рибонуклеазу раствором мочевины в присутствии восстановителя, разрывающего S―S-связь, нативная конформация этого белка изменяется, но после удаления вышеназванных реагентов из среды, рибонуклеаза ренатурирует.
Не только S―S-связи стабилизируют третичную структуру. Существует четыре типа взаимодействий, сочетание которых обеспечивает правильное взаимное расположение всех витков и петель в глобулярных белках.
Водородные связи возникают между R-группами остатков, расположенных в соседних петлях полипептидной цепи (между ОН-группой серина и азотом в кольце гистидина). Электростатическое протяжение формируется между противоположено заряженной R-группой (отрицательно заряженная карбоксильная группа остатка глутаминовой кислоты и положительно заряженной ε-аминогруппы остатка лизина).
Гидрофобные взаимодействия образуются в результате вытеснения молекулы Н2О из области, где локализуются гидрофобные аминокислотные остатки (они собираются вместе внутри глобулярной структуры и формируется гидрофобный кластер или участок).
Третичная структура белков является самой устойчивой, поскольку отвечает минимуму свободной энергии. При выполнении биологических функций такие белки претерпевают конформационные изменения
В природе существуют белки, состоящие из двух или более полипептидных цепей. Такие белки называются олигомерными, а каждая полипептидная цепь, входящая в состав олигомеров белка, называется субъединицей. Например, гексокиназа состоит из двух полипептидных цепей, аденилаткиназа – из трех, гемоглобин – из четырех, глутаматдегидрогеназа – из шести, глутаминсинтетаза – из двенадцати, а пируватдегидрогеназный комплекс – из семидесяти двух.
Все олигомерные белки имеют четвертичную структуру (то есть это способ совместной укладки нескольких субъединиц с образованием нативного конформационого олигомерного белка).
Дата добавления: 2015-08-14; просмотров: 711;
