Строение атома. Опыты Резерфорда. Постулаты Бора. Теория атома водорода.
| Ф |
| Э |
| И |
| Рис. 1. |
Основная часть альфа частиц отклоняется от первоначального направления на небольшие углы, но угол рассеяния небольшого количества альфа-частиц оказывается значительно большим и может достигать 180о. Резерфорд пришел к выводу, что отклонение альфа-частиц от первоначального направления возможно только, когда внутри атома имеется электрическое поле, которое создается зарядом, связанным с большой массой. Малая доля частиц, рассеиваемых на большие углы, указывает на то, что положительный заряд и связанная с ним масса сосредоточены в очень малом объеме и вероятность прямого попадания мала. Основываясь на этом выводе, Резерфорд предложил ядерную модель атома. Согласно Резерфорду атом представляет собой систему зарядов, в центре которой расположено тяжелое положительно заряженное ядро, имеющее размеры до 10-12 см, а вокруг ядра вращаются отрицательно заряженные электроны, суммарный заряд которых равен по модулю заряду ядра. Почти вся масса атома сосредоточена в ядре.
Но электрон, двигаясь по искривленной траектории должен иметь центростремительное ускорение. По законам классической электродинамики заряд, движущийся с ускорением, должен непрерывно излучать электромагнитные волны. Процесс излучения сопровождается потерей энергии, так что электрон должен постепенно опускаться, двигаясь по спирали и, в конечном счете, упасть на ядро. При этом, непрерывно изменяя радиус своей орбиты, он должен излучать сплошной спектр, но в опытах с разреженными газами установлено, что спектры атомов являются линейчатыми. Противоречие.
Выход из противоречия предложил Нильс Бор, который следующие постулаты:
1) Из бесконечного множества электронных орбит, возможных для электрона в атоме с точки зрения классической механики, на самом деле реализуются лишь некоторые, называемые стационарными. Находясь на стационарной орбите электрон не излучает энергию (э/м волны) хотя и движется с ускорением. Для стационарной орбиты момент импульса электрона должен быть целым кратным от постоянной величины
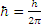 (
( 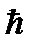 – постоянная Дирака). Т.е. должно выполняться соотношение:
– постоянная Дирака). Т.е. должно выполняться соотношение:
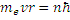 (1)
(1)
где me – масса электрона, v –скорость электрона, r – радиус электронной орбиты, n – целое число, которое может принимать значения 1, 2, 3, 4…и называется главным квантовым числом.
2) Излучение испускается или поглощается атомом в виде светового кванта энергии 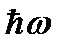 при переходе электрона из одного стационарного (устойчивого) состояния в другое. Величина светового кванта равна разности энергий тех стационарных состояний En1и En2, между которыми совершается квантовый скачок электрона:
при переходе электрона из одного стационарного (устойчивого) состояния в другое. Величина светового кванта равна разности энергий тех стационарных состояний En1и En2, между которыми совершается квантовый скачок электрона:
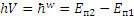 (2)
(2)
Такое же соотношение справедливо и для случая поглощения. Соотношение (2) называетсяправилом частот Бора.
В основу модели атома водорода Бор положил планетарную модель атома Резерфорда и постулаты. Из первого постулата Бора следует, что возможными являются лишь такие орбиты движения электрона вокруг ядра, для которых момент импульса электрона равен целому кратному от постоянной Дирака 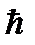 (см. (1)). Далее Бор применил законы классической физики. В соответствии со вторым законом Ньютона, для электрона, вращающегося вокруг ядра, кулоновская сила играет роль центростремительной силы и должно выполняться соотношение:
(см. (1)). Далее Бор применил законы классической физики. В соответствии со вторым законом Ньютона, для электрона, вращающегося вокруг ядра, кулоновская сила играет роль центростремительной силы и должно выполняться соотношение:
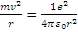 (3)
(3)
исключая скорость из уравнений (1) и (3), было получено выражение для радиусов допустимых орбит:
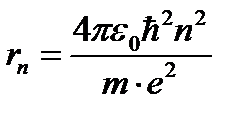
(4)
здесь n – главное квантовое число (n = 1,2,3…
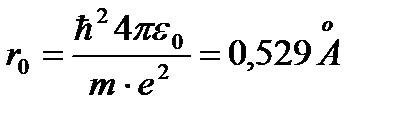 Радиус первой орбиты водородного атома называетсяБоровским радиусом и равен
Радиус первой орбиты водородного атома называетсяБоровским радиусом и равен
(5)
Внутренняя энергия атома равна сумме кинетической энергии электрона и потенциальной энергии взаимодействия электрона с ядром (ядро, ввиду его большой массы, в первом приближении считается неподвижным).
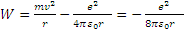 (6)
(6)
так как (смотри формулу (3))
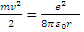 (7)
(7)
Подставив в (6) выражение rn из (4), найдём разрешённые значения внутренней энергии атома:
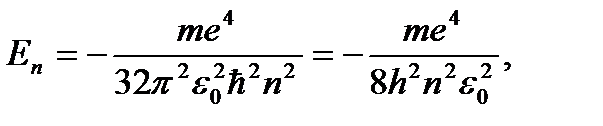
(8)
где n = 1, 2, 3, 4…
При переходе атома водорода из состояния n1 в состояние n2 излучается фотон.
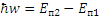 (9)
(9)
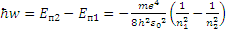 (10)
(10)
Обратная длина волны испускаемого света может быть рассчитана по формуле:
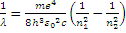 (11)
(11)
Дата добавления: 2015-08-14; просмотров: 1309;
