Закономерности в атомных спектрах.
При проведении экспериментальных исследований спектров излучения водорода Бальмер установил, что атомы водорода (как и атомы других элементов) излучают электромагнитные волны строго определённых частот. Причем оказалось, что величину, обратную длине волны спектральной линии, можно рассчитать, как разность, некоторых двух величин, которые называются спектральными термами, т.е. справедливо соотношение:
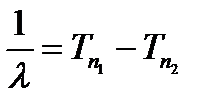
(12)
Количественная обработка экспериментально полученных спектров водорода показала, что термы можно записать следующим образом:
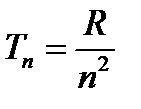
(13)
где R – постоянная Ридберга, а n – целое число, которое может принимать ряд целых значений 1,2,3...
С учетом вышесказанного длину волны любой спектральной линии водорода можно рассчитать по обобщенной формуле Бальмера:
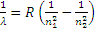 (15)
(15)
где числа n1 и n2 могут принимать значения: n1 = 1,2,3...; n2 = n1, n1+1, n1+2 …
Длины волн, рассчитанные по формуле (15), очень точно совпали с экспериментально измеренными значениями длин волн в спектре излучения водорода.
Сопоставив формулы (11) и (15) можно заключить, что формула (11) это та же обобщенная формула Бальмера, но полученная теоретически. Следовательно, значение постоянной Ридберга можно рассчитать по формуле:
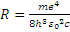 (16)
(16)
Числа n1, n2 –это квантовые числа, являющиеся это номерами стационарных орбит между которыми происходит квантовый скачок электрона. Если измерить значение постоянной Ридберга экспериментально, то, воспользовавшись соотношением (16) можно рассчитать постоянную Планка h.
Дата добавления: 2015-08-14; просмотров: 799;
