Использование стандартных электродных потенциалов для установления направления окислительно-восстановительных реакций при стандартных условиях. Ряды Латимера
Диаграмма Латимера представляет стандартные электродные потенциалы между различными формами одного элемента с разными степенями окисления.
Используя диаграмму Латимера, можно определить возможность реакции диспропорционирования. Если на диаграмме Латимера потенциал справа от рассматриваемой формы больше, чем потенциал слева, то эта форма склонна к диспропорционированию.
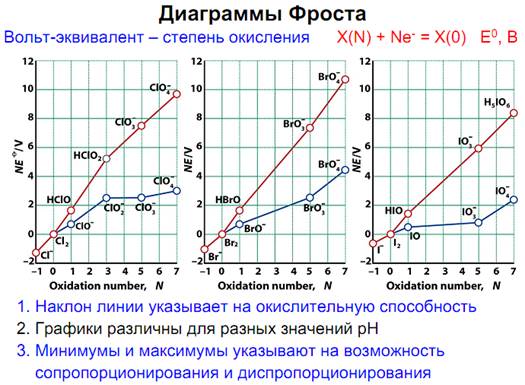
Билет№3. 1. Кислородные кислоты галогенов и их соли. Термодинамика окислительно-восстановительных процессов при рН=0 и рН=14 (диаграммы Фроста) на примере хлора. Межгалогенные соединения. Поликатионы и полианионы галогенов.
Гипогалогенитные кислоты НХО известны лишь в разбавленных водных растворах*. Их получают взаимодействием галогена с суспензией оксида ртути:
2Вг2 + 3HgO + Н20 = Hg302Br24 + 2НВrO
Гипогалогенитные кислоты являются слабыми. кислотные свойства в ряду НСЮ—НВгО—НЮ ослабляются, а основные увеличиваются. Иодноватистая кислота является уже амфотерным соединением. Устойчивость гипогалогенитов понижается вниз по группе.
Растворы гипогалогенитов имеют сильнощелочную реакцию, а пропускание через них С02 приводит к образованию кислоты:
NaCIO + Н20 + С02 = NaHC03 + НСЮ
Гипогалогенитные кислоты и их соли являются сильными окислителями:
6NaC10 + Br2 = 2NaBr03 + С12 + 4NaCl
2NaC10 + MnCl2 + 4NaOH = Na2Mn04 + 4NaCl + 2H20
Из оксокислот НХ02 известна хлористая кислота НСIO2.
НСIO2 получают обработкой суспензии Ва(СЮ2)2 разбавленной серной
кислотой:
Ва(СЮ2)2 + H2S04 = BaS044 + 2НСЮ2
Хлориты получают мягким восстановлением СlO2 в щелочной среде:
2СlO2 + Ва(ОН)2 + Н202 = Ва(СlO2)2 + 2Н20 + 02Т
2СlO2 + РЬО + 2NaOH = РЬ024 + 2NaCl02 + Н20
Оксокислоты НХ03 более устойчивые. Хлорноватая НСЮ3 и бромноватая НВЮ3 кислоты получены в растворах, а йодноватая НЮ3 выделена как индивидуальное вещество. Растворы НСlO3 и НВrO3 получают действием разбавленной H2S04 на растворы соответствующих солей
Ва(СlO3)2 + H2S04 = 2НСЮ3 + BaS04
Йодноватую получают окислением иода дымящей азотной кислотой, раствором пероксида водорода:
I2 + 5Н202 = 2НI3+4Н20
НХ03 являются сильными кислотами. В ряду НСlO3— НВrO3— НI3
хлорная кислота НС104 — бесцветная жидкость , смешивается с водой в любых соотношениях.
Ортоиодная кислота Н5IO6
Твердые галогенаты являются сильными окислителями:
2S + 2КВrO3 = K2S04 + Br2 + S02
Твердые хлораты являются сильными окислителями. галогены взаимодействуют друг с другом с образованием большого числа межгалогенных соединений. Известны также гомоядерные поликатионы и полианионы галогенов.
Межгалогенные соединения синтезируют при взаимодействии простых веществ.
С12 + 3F2 =2C1F3
I2 + 3F2=2IF3
Br2 + 5F=2BrF5
Все межгалогенные соединения разлагаются водой.
Br+5F5 +ЗН20 = HBr+503 + 5HF
Межгалогенные соединения являются сильными окислителями.
Йод при взаимодействии с сильнымикислотами Льюиса образует устойчивые поликатионы I2+, I3+, I5+. I42+
2I2 + 3AsF5= 2I2+[AsF6]- + AsF3
5I2 + 3AsF5S=2I2+[AsF6]- + AsF3
Поликатионы иода построены из цепей
Кроме гомоядерных получены и гетероядерные поликатионы, например C1F2:
ClF3+SbF5 = [ClF2]+[SbF6]-
Смешанные полианионы. синтезируют по реакции между галогенидом металла и галогеном: CsBr + С12 = CsBrCl2.
2. Цинк, кадмий, ртуть. Взаимодействие металлов с растворами кислот и щелочей. Сравнение кислотно-основных свойств оксидов и гидроксидов. Соли. Сравнение устойчивости их галогенидных комплексов.
Цинк, кадмий и ртуть . полностью заселенному d-уровню. Трудность отрыва третьего электрона, больших значениях третьей энергии ионизации. наиболее устойчива высшая степень окисления +2
При движении вниз по группе возрастают атомные и ионные радиусы.
Ртуть химически инертна; ион Hg2+ является довольно сильным окислителем
Цинк и кадмий взаимодействуют с кислотами-неокислителями с выделением водорода:
Cd + H2SO4(20 %) = CdS04 + H2
Металлы высокой чистоты устойчивы к действию растворов кислот. Цинк и кадмий взаимодействуют с серной и азотной. Состав продуктов восстановления определяется концентрацией раствора:
Zn + 4HN03(Komi.)= Zn(N03)2 + 2N02T + 2H20
3Zn + 8HNO3(40%) = 3Zn(N03)2 + 2NOT + 4H20
4Zn + 10HNO3(20%) = 4Zn(N03)2 + N2OT + 5H20
5Zn + 12HN03(6%) = 5Zn(N03)2 + N2T + 6H20
4Zn+ 10HNO3(0,5%) = = 4Zn(N03)2 + NH4N03 + 3H20
Ртуть не восстанавливает ионы Н+. На холоду не взаимодействует с концентрированной серной кислотой. при нагревании происходит окисление:
Hg + 2H2S04(kohU.) = HgS04 + S02T + 2Н20
Растворением ртути в царской водке получают сулему HgCl2. с растворами щелочей реагирует только цинк:
Zn + 2NaOH + 2Н20 = Na2[Zn(OH)4] + Н2
В сильнощелочной среде цинк является сильным восстановителем
4Zn + NaN03 + 7NaOH + 6H20 = 4Na2[Zn(OH)4] + NH3
Оксид цинка амфотерен: он легко растворяется в растворах щелочей, а оксид ртути(Н) с растворами щелочей не взаимодействует. основные свойства оксидов усиливаются при движении вниз по группе.
Гидроксидцинка, гидроксид кадмия лишь на порядок его слабее. гидроксид цинка Zh(OH)2 легко растворяется в избытке щелочей:
Zn(OH)2 + NaOH + H20 = Na[Zn(OH)3(H20)]
гидроксид кадмия Cd(OH)2 растворяется лишь в очень концентрированном щелочном растворе.
соли ртути(1) устойчивы лишь с анионамикислородсодержащих кислот, а также с хлоридом и бромидом. нитрат, кристаллизующийся в виде Hg2(N03)2(H20)2 из растворов, полученных взаимодействием избытка ртути с разбавленной азотной кислотой. При действии на раствор нитрата избытка серной кислоты из раствора кристаллизуется малорастворимый сульфат Hg2S04.
Соли цинка и кадмия с анионами кислородсодержащих кислот изоморфны солям магния, менее устойчивы при нагревании. Безводные карбонаты, сульфаты, нитраты термически разлагаются до оксидов. Для обоих металлов известны кислые M(HS04)2 и основные соли M2(OH)2S04. Кислые сульфаты получают кристаллизацией из серной кислоты, а основные — нейтрализацией растворов сульфатов Нитраты цинка и кадмия получают растворением карбонатов или гидроксидов в азотной кислоте. основные соли Zn2P04(OH) и Cd5(P04)3OH. получают осаждением раствором среднего фосфата и кипячением полученного осадка с водой. Кислые соли М(Н2Р04)2 образуются при взаимодействии карбонатов с избытком фосфорной кислоты.
Чистый карбонат кадмия CdC03 получают растворением образующегося осадка в аммиаке и кипячением полученного раствора, в котором кадмий
Дата добавления: 2015-08-11; просмотров: 4950;
