Оксиды.
Билет.
1). Рутений. Ст.ок. – (-2), 0,+3,+4,+6,+8(устойчивая)
Рутений не растворяется в кислотах и царской водке (смеси HCl и HNO3). Вместе с тем рутений реагирует с хлором выше 400 °C (образуется RuCl3) и со смесью щелочи и нитрата при сплавлении (образуются рутенаты, например Na2RuO4). В сплаве с платиной медленно растворяется в царской водке, превращаясь в рутениевохлористоводородную кислоту H2[RuCl6].
Мелкодисперсный Рутений окисляется в струе кислорода до диоксида RuO2. Рутений с фтором- RuF6, рутений с хлором до 250 0С- RuCl2, до 125 0С RuCl3, RuS2 - Получают нагреванием смеси порошкообразного рутения с серой или действием сероводорода на растворы солей рутения (IV).
Известно несколько оксидов рутения.При взаимодействии K2RuO4 c гидроксидом калия КОН и газообразнымхлором, а также при действии на K2RuO4 перманганата калия KMnO4 или других сильных окислителей возникает легколетучий тетраоксид RuO4.
Разлагается при нагревании: 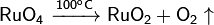
Является сильным окислителем:
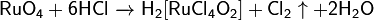 ;
; 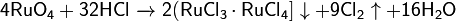
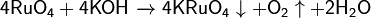 ;
; 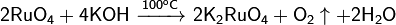 ;
; 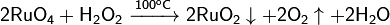
Прокаливанием на воздухе такой соли рутения, как (NH4)2[RuCl6], или гидроксида рутения Ru (OH)4получается темно-синий порошок диоксида рутения RuО2. Он нерастворим в воде, кислотах и щелочах. При его сплавлении с основными оксидами типа SrO, BaO, PbO и другими образуются рутенаты SrRuO3, BaRuO3и PbRuO3.
Разлагается при нагревании: 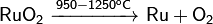 ;
; 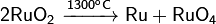
Растворяется в концентрированной соляной кислоте, насыщенной хлором:

Окисляется кислородом: 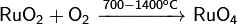
Реагирует с перекисью натрия при сплавлении: 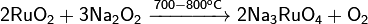 Восстанавливается водородом:
Восстанавливается водородом: 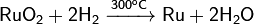
Гидроксид рутения(3)образует чёрный осадок, не растворяется в воде.
Действие щелочей на соли рутения(III): 
Окисление гидроксида рутения(II): 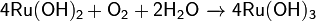
Гидроксид рутения(2) коричневый осадок, не растворяется в воде, Мало устойчив
Действие щелочей на хлорид рутения(II): 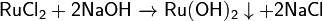
Для рутения в разных степенях окисления характерно образование комплексных соединений. При длительном нагревании растворов соединений трехвалентного рутения в аммиачной среде образуется «красная рутениевая соль» состава [Ru3O2(NH3)14]Cl6·4H2O. Взаимодействием RuO4 c раствором хлорида калия в среде соляной кислоты получают «бурую соль» состава K4[Ru2OCl10]·H2O — промежуточное вещество при извлечении рутения из природных материалов.
Осмий. +8, +6, +4, +3, +2, 0, (−2)
Порошок осмия при нагревании реагирует с кислородом, галогенами(OsF4-Получают пропусканием фтора над нагретым до 280°С металлическим осмием, OsF6 -Получают вместе с OsF4 и OsF8 при нагревании осмия в среде фтора, OsF8- Образуется при быстром охлаждении паров, полученных пропусканием фтора над нагретым до 250оС металлическим осмием; OsCl2 -Получают нагреванием хлорида осмия (III) при 500оС и пониженном давлении, OsCl3 -Получают быстрым охлаждением паров, выделяющихся при нагревании металлического осмия в хлоре при 1050оС, OsCl4-Получают обработкой OsО4 концентрированной HCl ), парами серы(OsS2Черные кубические кристаллы. Мало растворим в воде и спирте. При нагревании на воздухе превращается в OsO4. Восстанавливается водородом до металла. Получают прямым взаимодействием элементов при нагревании.(взаим-ет ещё с йодом- OsI2.) ),азотной и серной кислотами. Компактный осмий не взаимодействует ни с кислотами, ни со щелочами, но с расплавами щелочей образует водорастворимые осматы(OsO42-). Медленно реагирует с азотной кислотой и царской водкой, реагирует с расплавленными щелочами в присутствии окислителей (нитрата или хлората калия), с расплавленной перекисью натрия.
Оксиды.
OsO.Серовато-черный порошок, мало растворимый в воде и кислотах. Получают нагреванием смеси осмия, сульфита осмия (II) и карбоната натрия в токе диоксида углерода.
Os2O3.Темно-коричневый порошок (или медно-красные чешуйки), мало растворимый в воде. Получают восстановлением OsO4 металлическим осмием при нагревании.
OsO2.Коричнево-красные гексагональные кристаллы. Мало растворим в воде и кислотах. Получают нагреванием тонкодисперсного металлического осмия в парах OsO4.
OsO4.Диамагнитные светло-желтые моноклинные кристаллыОбладает резким запахом. Растворяется в воде, спирте, эфире. Пары очень токсичны. Проявляет окислительные свойства. Получают окислением тонкоизмельченного порошка металлического осмия кислородом при комнатной температуре.
(Про гидроксиды осмия не нашла)
Осмий — один из немногих металлов, образующих полиядерные (или кластерные) соединения. Полиядерный карбонил осмия Os3(CO)12 используется для моделирования и исследования химических реакций углеводородов на металлических центрах. Карбонильные группы в Os3(CO)12 могут замещаться на другие лиганды, в том числе и содержащие кластерные ядра других переходных металлов.
Дата добавления: 2015-08-11; просмотров: 2700;
