Билет №4. Аллотропия кислорода. Вода, оксиды. Пероксиды, надпероксиды. Озониды. Фторид кислорода. Обратимое связывание кислорода гемоглобином.
Аллотропия способность одного и того же элемента образовывать несколько простых веществ. три аллотропные формы кислорода: 02, озон 03 и крайне неустойчивый тетракислород 04. Озон. Бесцветный газ с резким запахом, малорастворимый в воде
Озон образуется при действии на кислород электрического разряда Диамагнитная молекула озона 03 имеет угловую форму.
Озон — более сильный окислитель, чем кислород:
В отличие от кислорода он мгновенно окисляет подкисленный раствор иодида калия:
03 + 2KI + H2S04 = 02t + I2 + K2S04 + H20
превращает диоксид азота в азотный ангидрид:
03 + 2N02 = N2Os + 02
Восстановительными свойствами озон не обладает. При пропускании его над твердой щелочью образуются красные озониды
ЗКОHтв. + 203 = 2К03 + КОН • Н20 + '/2 02
Озониды крайне неустойчивы и разлагаются при хранении Озониды подобно озону являются сильными окислителями. В воде они постепенно разлагаются:
4К03 + 2Н20 = 4КОН + 502
Озониды — это соединения, состоящие из положительно заряженных ионов металла и отрицательно заряженных ионов O3-. Парамагнетизм. Обычно они окрашены в красный цвет.
Кислород отличается высокой реакционной способностью и окисляет многие простые и сложные вещества Особенно сильным окислителем является жидкий. 02 не реагирует лишь с инертными газами, галогенами (за исключением фтора), серебром, золотом и платиновыми металлами (кроме осмия).
Н20 sp3-гибридизации. а воды имеет угловую форму. взаимным отталкиванием двух неподеленных электронных пар кислорода. В периодах осществляется постепенный переход от основных через амфотерные оксиды к кислотным.
Различие в свойствах оксидов разного типа проявляется при их взаимодействии с водой:
N a2O + Н2О = 2N aOH;
2Н2О + Р2О5 = 2Н3Р О4
а также при взаимодействии оксидов разного типа друг с другом:
ЗСаО + Р2О5 = С а3( РО4)2
Амфотерные оксиды с водой не взаимодействуют, но могут реагировать и с кислотами, и с щелочами:
А12О3 + 6НС1 + 9Н2О = 2[А1(ОН2)6]С1з
6NaOH + А12О3 + ЗН2О = 2Na3[Al(OH)6]
Соединения пероксидного типа. Присоединение одного электрона к молекуле О2 вызывает образование надпероксид-иона 02-.; они известны для наиболее активных щелочных металлов (К, Rb, Cs). Надпероксиды образуются при прямом взаимодействии простых веществ:
К + 02 = КО2
парамагнетизм надпероксидов. Надпероксиды — очень сильные окислители. бурно реагируют с водой с выделением кислорода. Присоединяя два электрона, молекула О2 превращается в пероксид-ион О2-, диамагнитен. Пероксиды образуются при окислении ряда металлов, например:
Ва + 02 = ВаО2
Н2О2 сильно полярна. Между молекулами Н2О2. возникает прочная водородная связь,. Пероксид водорода — хороший ионизирующий растворитель. С водой смешивается в любых отношениях благодаря возникновению новых водородных связей
ВаО2 + H2SO4 = BaSO4 + Н2О2
О2 2- —> 20 2-(окислитель)
О22- —> О0 (восстановитель)
В первом случае пероксиды проявляют окислительные свойства, во втором — восстановительные. Например:
2KI + Na2O2 + 2H2SO4 = I2 + Na2SO4 + K2SO4 + 2H26 (окислитель)
2KMnO4 + 5H262 + 3H2SO4 = 2MnSO4 + 5O2 + K2SO4 + 8H2O (восстановитель)
Окислительные свойства пероксидов выражены сильнее, чем восстановительные:
пероксида водорода диспропорционирования:
Н2О2 + Н2О2 = 2Н2О + О2
его соединениях с фтором: 0F2 , O2F2, NO3F, ClO4F.
Дифторид кислорода OF2 получают при быстром пропускании фтора через раствор щелочи:
2F2 + 2NaOH = OF2 + 2NaF + H2O
Дифторид кислорода — ядовитый газ, термически устойчив, сильный окислитель. Диоксидифторид O2F2 образуется при взаимодействии простых веществ в электрическом разряде.
Соединение крайне неустойчиво.
Связывание кислорода гемоглобином зависит от четырех факторов: 1) парциального давления ; 2) pH; 3) концентрации 2,3-бисфосфоглицерата и 4) концентрации. Обратимое связывание кислорода гемоглобином сопровождается высвобождением прогонов в соответствии с уравнением
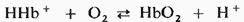
с ростом pH равновесие сдвигаться вправо и при данном парциальном давлении связывание кислорода увеличится. при понижении pH связывание кислорода уменьшится.
Германий, олово, свинец. Диаграммы окислительно-восстановительных свойств. Взаимодействие металлов с растворами кислот и щелочей. Оксиды и (окси)гидроксиды. Соединения с активными металлами и водородом.
В основном состоянии их атомы имеют электронную конфигурацию ns2np2.
Атомные радиусы в ряду Ge—Sn—РЬ увеличиваются. сжатию электронных оболочек Ge и РЬ из-за повышения эффективного заряда ядра.
В химических соединениях проявляют степени окисления -4, 0, +2, +4. Устойчивость соединений с высшей степенью постепенно понижается в ряду Ge—Sn—РЬ. устойчивость веществ со степенью окисления +2, возрастает, соединения Ge(II) и Sn(II) являются сильными восстановителями, РЬ (П) восстановительные свойства не характерны.
При движении сверху вниз окислительные свойства соединений с высшей степенью окисления усиливаются, а восстановительные свойства соединений с низкой степенью окисления ослабевают.
с кислотами-неокислителями реагируют лишь олово и свинец. германий растворяются в смеси концентрированных кислот (HN03 + HF, HN03 + HC1),
3Ge + 4HN03 + 18HC1 = 3H2[GeCl6] + 4NOT + 8H20
Олово легко растворяется в разбавленных кислотах (HCl, H2S04):
Sn + 2HC1 = SnCl2 + H2
Реакция с концентрированной азотной кислотой приводит к образованию осадка а-оловянной кислоты Sn02 • хН20:
Sn + 4HN03(koh4.) = Sn02xH204 + 4N02t + (2 - x)H20
Нитрат олова(И) образуется при взаимодействии металла с очень разбавленной азотной кислотой:
4Sn + 10HNO3(pa36.) = 4Sn(N03)2 + NH4N03 + 3H20
Растворение свинца легче всего происходит в хлорной и разбавленной азотной кислоте:
ЗРЬ + 8HN03(pa36.) = 3Pb(N03)2 + 2NOT + 4Н20
а в присутствии окислителя — и в уксусной кислоте:
РЬ + 2СН3СООН + '/202 = РЬ(СН3СОО)2 + Н20
Реакция с соляной кислотой протекает при нагревании, так как образующийся хлорид РЬС12 на холоде малорастворим. С серной кислотой свинец практически не реагирует, пассивирует его и очень крепкая азотная кислота.
Реакция германия с щелочами протекает лишь в присутствии окислителей:
Ge + 2К0Н + 2Н202 = K2Ge03 + ЗН20
Олово по сравнению с германием более активно и окисляется горячими растворами щелочей до гексагидроксостанната(3):
Sn + NaOH + 2H20 = Na[Sn(OH)3] + H2
Свинец с щелочами не взаимодействует.
Водородные соединения Ge, Sn и РЬ называются германами, станнанами и плюмбанами. понижается их устойчивость.
Германий, олово и свинец с водородом не взаимодействуют, их гидриды получают действием тетрагидроалюмината лития на тетрахлориды,
SiCl4 + Li[AlH4] = SiH4t + LiCl + A1C13.
уменьшению термической устойчивости водородных соединений. Плюмбан РЬН4 был получен лишь в следовых количествах и практически не охарактеризован. GeH4 активно взаимодействуют с водой, гидролиз существенно ускоряется щелочами:
GeiH4 + 2NaOH + Н20 = Na2Ge03 + 4H2
герман и станнан являются сильными восстановителями:
GeH4 + 2AgCl = GeH3Cl + НС1 + 2Ag
при нагревании они разлагаются:
МН4 = М + 2Н2
При замещении водорода на металл в гидридах образуются их производные — карбиды, силициды, германиды, станниды и плюмбиды.
В кислородных соединениях элементы проявляют степени окисления +2, +4.
вниз по группе ослабевают кислотные и усиливаются основные свойства. диоксиды германия, олова и свинца являются амфотерными, для РЬ02 основные свойства уже преобладают. РЬ02 является сильным окислителем.
Диоксид олова Sn02 — амфотерное с преобладанием основных свойств, нерастворимое в воде и разбавленных растворах кислот и щелочей. Легко растворяется в расплавленных гидроксидах щелочных металлов, образуя станнаты:
Sn02 + 2NaOH =Na2Sn03 + H2O
Диоксиды Ge02, Sn02 обладают слабыми окислительными свойствами и могут быть восстановлены до металла углеродом (как и РЬ02):
М02 + 2С = М + 2СОТ
Диоксид свинца РЬ02 — Получают его электролизом или окислением растворимых солей РЬ(П) сильными окислителями, например:
РЬ(СН3СОО)2+ СаОС12 + Н20 = РЬ021 + 2СН3СООН + СаС12
или в среде NaOH:
РЬО + NaOCl = Pb02l + NaCl
В воде, разбавленных кислотах НС1, HN03, H2S04 и щелочах РЬ02 не растворяется. В смесях с концентрированными кислотами РЬ02 действует как сильный окислитель, например:
РЬ02 + 4HC1 = РЬС121 + С12Т + 2Н20
2Pb02 + 2H2S04 = 2PbS04! + 02t + 2H20
очень сильным окислителем, диоксид РЬ02 способен окислить воду до кислорода Для олова и свинца известны оксиды со смешанными степенями окисления катионов, например РЬ304 — свинцовый сурик, Он образуется при прокаливании высшего оксида свинца:
3Pb02=Pb304 + 02
Присутствие в сурике атомов свинца в разных степенях окисления можно доказать, обрабатывая его ледяной уксусной кислотой, в результате чего образуется смесь ацетатов РЬ(П) и Pb(IV):
Pb304 + 8СН3СООН = Pb(CH3COO)4 + 4Н20 + 2Pb(CH3COO)2
или азотной кислотой, при этом образуется осадок диоксида:
РЬ304 + 4HN03 = РЬ021 + 2Pb(N03)2 + 2Н20
Состав высших гидроксидов германия, олова и свинца не соответствует простым формулам Н2М03 или М(ОН)4. Они представляют собой гидратированные диоксиды М02 • хН20. Монооксид германия образуется в результате cопропорционирования простых веществ с диоксидами
Ge02 + Ge = 2GeO
Он является сильным восстановителем. Оксиды Sn(II) и РЬ(П) образуются в результате термического разложения ряда солей или гидратированных оксидов олова(П) и свинца(П) без доступа воздуха:
Pb(N03)2 = РЬО + 2N02 + 02
РЬС03 = РЬО + С02
Оксид олова(П) образуется лишь при мягком нагревании в инертной или восстановительной атмосфере:
SnC204 = SnO + CO + C02
Монооксид SnO и его гидроксидные формы — а типичные амфотерные соединения: легко растворяются в кислотах, образуя соответствующие соли или комплексы Sn(II), и в щелочах, давая гидроксоион Sn(OH)3. При действии оснований на растворы солей олова(П) осаждаются не гидроксиды простого состава Sn(OH)2, а оксогидроксиды Sn604(OH)4.
6SnS04 + 12NH3 + 8Н20 = Sn604(OH)4 + 6(NH4)2S04
Оксид и гидроксид олова(П) являются амфотерными — при растворении их в щелочах образуются гидроксостаннаты(П), В горячих растворах они диспропорционируют:
2Na[Sn(OH)3] = Sni + Na2[Sn(OH)6]
РЬО проявляет преимущественно основные свойства:
РЬО + 2HN03 = Pb(N03)2 + H20
Восстановительные свойства соединений ослабевают в ряду Ge(II) — Sn(II) — Pb(II). германий, олово и свинец образуют с некоторыми металлами металлиды: германиды, станиды, плюмбиды
Дата добавления: 2015-08-11; просмотров: 4216;
