Коагулирование воды. Обработка воды коагулированием - добавление в воду раствора солей Fe и Al, или их смеси
Обработка воды коагулированием - добавление в воду раствора солей Fe и Al, или их смеси. Коагулирование - это процесс укрупнения коллоидных частиц за счет их слипания под влиянием молекулярных сил притяжения.
Наиболее часто применяемые коагулянты:
- сульфат алюминия (очищенный) - А12(SО4)3* 18H2O
- алюминат натрия - NaAlO2
- полихлорид алюминия - Аl2(ОН)п*С16-п
- квасцы алюмокалиевые - KAl(SO4)2* 12Н2О
- хлорное железо - FеС13*6Н2O
- железный купорос - FeSO4*7H2O и т.д.
Коллоидные системы состоят из воды, являющейся дисперсной средой, и массы распределенных в ней коллоидных частиц, являющимися дисперсной фазой. Устойчивость коллоидных систем зависит абсорбционных и электрокинетических свойств коллоидных части обладающих сложной структурой (адсорбция - явление изменения содержания данного компонента в поверхностном слое по сравнению; с содержанием его во внутренних слоях). При погружении в природную воду, т.е. раствор электролита, твердого тела поверхность его выделяет или адсорбирует из него ионы. Адсорбируются обычно ионы, входящие в состав этого твердого тела. В результате поглощения ионов или выделения их в раствор поверхность тела приобретает заряд. Противоположно заряженные ионы, находящиеся растворе, собираются у его поверхности вследствие электростатического притяжения, образуя коллоидную частицу.
Тепловое движение ионов в растворе сообщает слою окружающих частицу противоионов диффузный характер (чем дальше от поверхности частицы, тем меньше концентрация избыточных против ионов).
Коллоидная частичка вместе с окружающим диффузным слоем называется мицеллой. Формула мицеллы золя гидроксида железа:
{m[Fe(OH)3]n 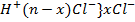 ,
,
где Fe(OH)3 - ядро
nH+ - потенциально образованные ионы;
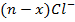 и
и 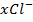 - противоионы (образуют второй электрический слой);
- противоионы (образуют второй электрический слой);
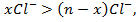 в результате частица имеет положительный заряд;
в результате частица имеет положительный заряд;
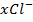 образуют диффузный слой.
образуют диффузный слой.
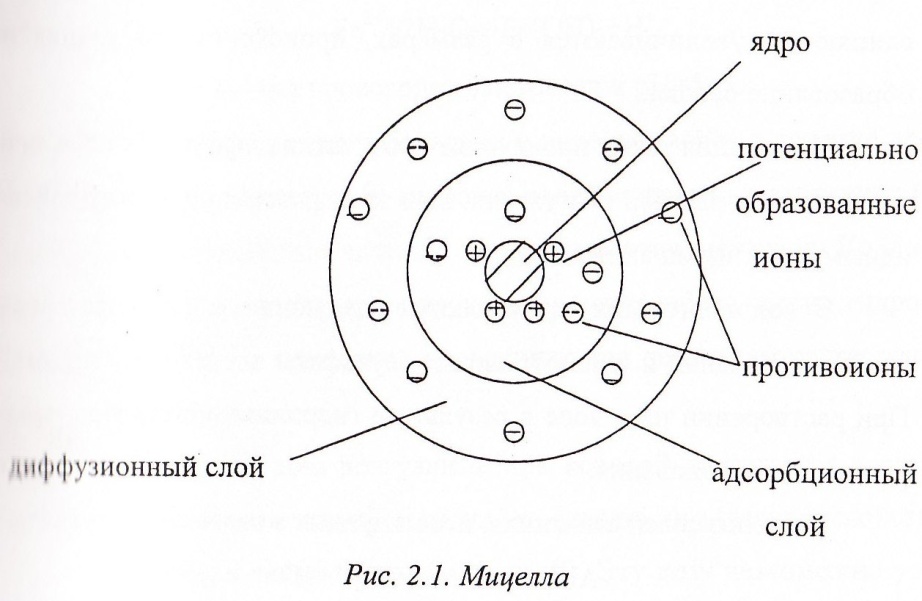
Рис. 3.1. Мицелла
Формула мицеллы золя, образующегося при гидролизе хлорида алюминия:
{m[Al(OH)3]n 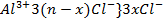 .
.
В отличие от золей коагулянтов большинство природных вод заряжено отрицательно. К таким коллоидам относятся кремнекислота и гуминовые вещества: мицелла SiO2 имеет следующий вид:
{(Si02)mnSi  2(n-x)H+}2x H+
2(n-x)H+}2x H+
При движении коллоидных частиц некоторый слой ионов остается неподвижным, связанным с их поверхностью. Часть же ионов диффузного слоя отрывается от частицы, при этом возникает разность потенциалов, так называемый дзета-потенциал (  -потенциал), который может рассматриваться как мера стабильности коллоидных систем. При снижении
-потенциал), который может рассматриваться как мера стабильности коллоидных систем. При снижении  - потенциала уменьшается стабильность системы. Коагуляция коллоидных систем наступает при критическом значении
- потенциала уменьшается стабильность системы. Коагуляция коллоидных систем наступает при критическом значении  - потенциала, когда силы отталкивания между одноименно заряженными частицами уменьшаются, частицы слипаются, увеличиваются в размерах, происходит коагуляция и образование осадка.
- потенциала, когда силы отталкивания между одноименно заряженными частицами уменьшаются, частицы слипаются, увеличиваются в размерах, происходит коагуляция и образование осадка.
Коагуляция также происходит при сжатии диффузного слоя, при добавлении в раствор коагулянта. При этом расстояние между коллоидными частицами снижается.
В водоподготовке применяются следующие коагулянты: соли слабых оснований и сильных кислот (сульфаты алюминия и железа). При растворении их в воде в результате гидролиза образуются малорастворимые основания.
Гидролиз солей алюминия, используемых в качестве коагулянта:
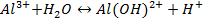
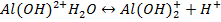
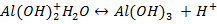
или суммарно: 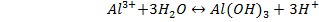
Степень гидролиза возрастает со снижением концентрации раствора, а также при увеличении его температуры и рН. Гидролиз алюминия - амфотерное соединение, т.е. обладает кислыми и щелочными свойствами.
Концентрация водородных ионов, при которой гидролиз алюминия имеет минимальную растворимость, находится в пределах рН = 6  Осаждение гидроксида алюминия начинается при рН = 3 и достигает полноты при рН = 7. При дальнейшем увеличении рН осадок начинает растворяться, при рН = 9 растворение становится заметным.
Осаждение гидроксида алюминия начинается при рН = 3 и достигает полноты при рН = 7. При дальнейшем увеличении рН осадок начинает растворяться, при рН = 9 растворение становится заметным.
Гидролиз железного купороса протекает в два этапа:
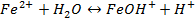

или суммарно:
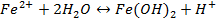
Гидролиз железа происходит быстрее при рН = 5  . Таким образом, при добавлении к воде растворов в течение нескольких секунд происходит гидролиз солей железа или алюминия и образуются коллоидные частицы гидроксида этих металлов. Коллоидные примеси из воды адсорбируются на поверхности частиц гидроксидов металлов, и осаждение происходит под действием растворенных в воде электролитов.
. Таким образом, при добавлении к воде растворов в течение нескольких секунд происходит гидролиз солей железа или алюминия и образуются коллоидные частицы гидроксида этих металлов. Коллоидные примеси из воды адсорбируются на поверхности частиц гидроксидов металлов, и осаждение происходит под действием растворенных в воде электролитов.
Оптимальная доза коагулянта, при которой достигается достаточно быстрое осветление, зависит от физико-химических свойств примесей воды, а также от ее температуры. Эту дозу невозможно установить, пользуясь только данными анализа воды. Определяют ее экспериментальным методом лабораторного коагулирования. Опыты по определению оптимальной дозы коагулянта и оптимальных значений рН нужно проводить по сезонам года, чтобы иметь возможность корректировать их в зависимости от изменения состава воды.
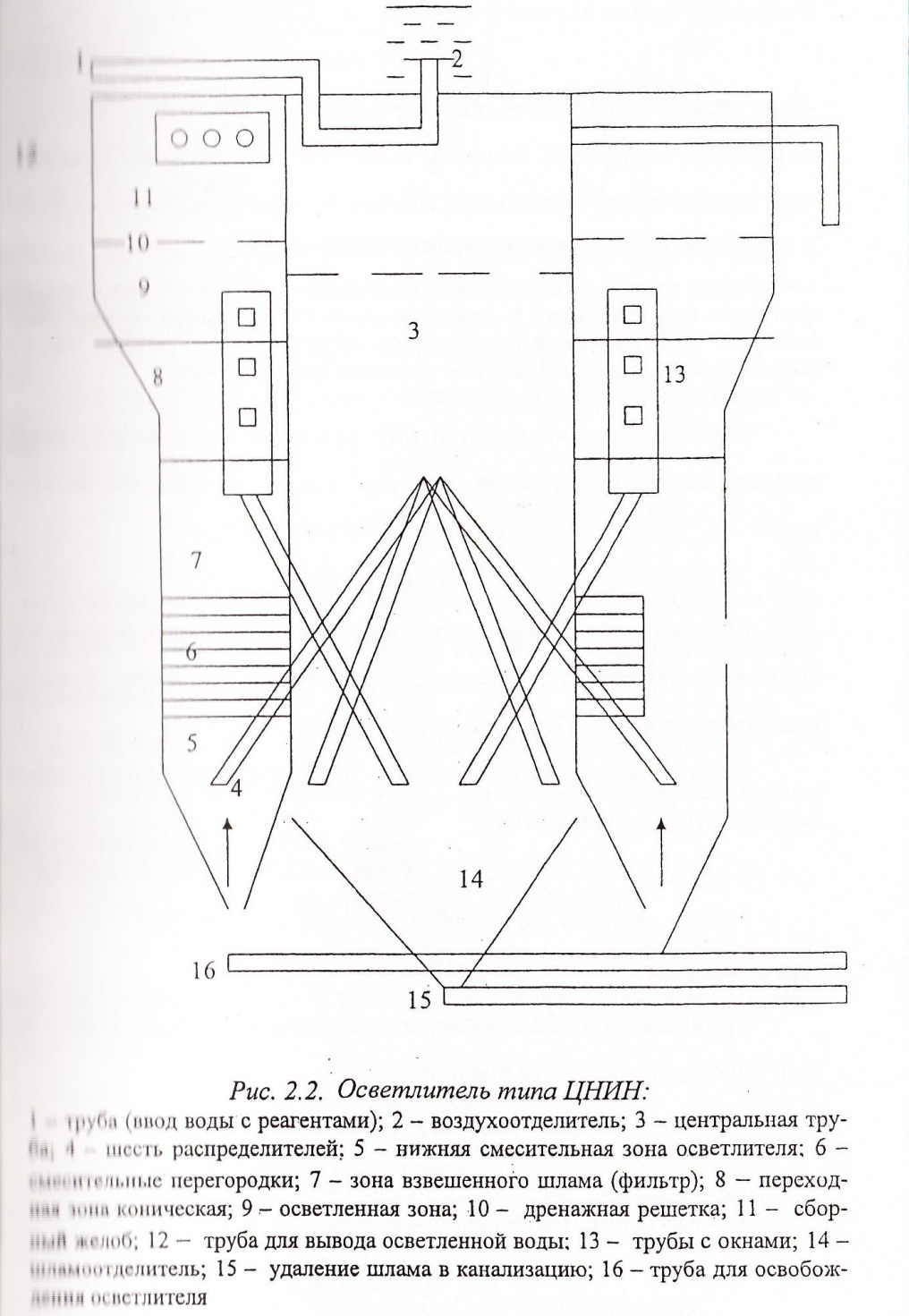
Дни интенсивного процесса коагуляции в дополнение к основным коагулянтам применяют флокулянты, которые по химическому составу бывают: минеральные (активированная кремниевая кислота) и органические (полиакрил натрия, полиакриламид). Некоторая интенсификация процесса может быть достигнута применением окислителей: O2, O3, С12 или KMnO4 (перманганат калия). На рис. 2.2 приведена схема осветлителя типа ЦНИН.
Дата добавления: 2015-08-11; просмотров: 1359;
