Коагулирование воды
Процесс укрепления частиц дисперсной системы вследствие их взаимного слипания называется коагуляцией. Взаимное слипание частиц происходит под действием сил притяжения между частицами, которые имеют молекулярную природу и называются силами Ван-дер-Ваальса-Лондона.
Силы притяжения действуют при достаточном сближении частиц или столкновении их друг и другом, эти силы быстро уменьшаются с увеличением расстояния между частицами.
Сближение и столкновение частиц друг с другом происходит в результате их взаимного перемещения при беспорядочном тепловом броуновском движении, при перемешивании или при направленном движении частиц с различными скоростями.
Но между сблизившимися частицами действуют и силы отталкивания, возникновение которых связывается с существованием вокруг частиц двойного электрического слоя, состоящего из противоположно заряженных ионов.
Системы, в которых преобладают силы отталкивания, называются устойчивыми. Системы, в которых преобладают силы притяжения называются неустойчивыми, коагулирующими.
Природная вода, как дисперсная система устойчива. При сближении частиц, благодаря наличию двойного электрического слоя, возникают электростатические силы отталкивания: они накладываются на Ван-дер-ваальсовые силы молекулярного притяжения. Результирующее действие этих сил приводит к тому, что с уменьшением расстояния между частицами силы отталкивания сначала увеличиваются, достигают максимума и при дальнейшем сближении частиц начинают убывать. Затем отталкивание переходит в притяжение.
С уменьшением величины заряда частицы, силы отталкивания уменьшаются. Наиболее быстро коагуляция идет тогда, когда частица не имеет электрического заряда. Однако природная вода содержит, в основном, глинистые частицы и коллоидные частицы гумуса, при сближении которых преобладают силы отталкивания. Молекулы веществ, находящихся на поверхности частиц взвеси, соприкасающейся с жидкой средой, способны диссоциировать как кислоты или как щелочи. Результатом этой диссоциации и является образование двойного электрического поля.
«Потенциал на границе адсорбционного слоя носит название электрокинетического потенциала или дзета-потенциал.»
( 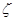 - потенциал).
- потенциал).
Максимальная сила отталкивания («Силовой барьер»), возникающая между одноименно заряженными разнородными частицами, зависит только от величины заряда частиц, заряженной слабее.
Если заряд частиц какого-либо одного вещества мал или равен нулю, то эти частицы могут не только слипаться друг с другом, но и с частицами другого вещества, хотя эти последние остаются устойчивыми в отношении слипания между собой.
В смеси различных коллоидных веществ и суспензий достаточно, чтобы частицы одного какого-либо вещества оказались неустойчивыми, чтобы вся система начала коагулировать.
В воде при ее химической обработке неустойчивым компонентом является коллоидная гидроокись алюминия или железа, образующаяся в результате гидролиза коагулянтов.
Коагулянтами называют химические реагенты, которые добавляют к воде для того, чтобы вызвать коагуляцию. Наиболее широко применяемыми коагулянтами при очистке воды являются: сернокислый алюминий A12(S04)3,•18Н2О, железный купорос FeS04×7Н2О, хлорное железо FeС13•6Н2О, алюминат натрия NaAlO2.
Сернокислый алюминий - основной коагулянт, применяемый на городских водопроводах, который получают путем обработки серной кислотой бокситов, коалинов и других глин, содержащих окись алюминия. Промышленностью выпускается два вида сернокислого алюминия: очищенный и неочищенный.
В очищенном сернокислом алюминии содержание безводного AI2(SO4)3 составляет не менее 45,3% (в расчет обычно принимают 50%).
В неочищенном содержание безводного Al2(SO4)3 составляет 33,5%.
Объемный вес сернокислого алюминия находится в пределах 1,05 - 1,1т. Удельный вес Al2(SO4)3•18Н2О=1,62, растворимость в воде при температуре ее 20° - 262 г/л.
При введении в воду сернокислый алюминий вступает в реакцию с двууглекислыми солями кальция и магния (гидрокарбонатами), в основном обусловливающими щелочность воды.
Ход реакции может быть упрощенно представлен следующими уравнениями:
А12(SO4)3 +ЗСа(НСО3)2 =2А1(ОН)3 + 3CaS04 + 6СО2
А12(SO4)3 + 3Mg(HC03) 2 = 2А1(ОН)3 + 3MgS04 + 6СО3
образующаяся в результате реакции гидроокись алюминия Аl(ОН)3, представляет собой коллоидное вещество, агрегативно неустойчивое и быстро коагулирующее. Существует два вида коагуляции: перекинетическая и ортокинетическая. В процессе коагуляции частицы гидроокиси обволакивают взвешенные в воде частицы загрязнений, захватывают их и образуют хлопья. При наличии в воде коллоидных гуминовых веществ (обуславливающих цветность воды) происходит их сорбция на частицах гидроокиси.
При недостаточной щелочности природных вод, не обеспечивающей ход реакции, производится подщелачивания воды, гашеной известью, содой, или едким натром. При подщелачивании гашеной известью Са(ОН)2 реакция идет следующим образом:
Аl2(SO4)3+ЗСа(ОН)2=2А1(ОН)3+ЗСаSO4
Хлорное железо - темные кристаллы и металлическим блеском получают путем хлорирования стальных стружек при температуре 700°. Удельный вес 2.80. Растворимость в воде при 20° составляет 919 г/л. В результате реакции образуется Гидроокись железа.
Железный купорос - прозрачные кристаллы зеленого цвета - получают обычно в виде отхода при травлении черных металлов серной кислотой. Удельный вес 2.99. Растворимость при 20° - 265 г/л.
для ускоренного процесса реакции (перехода закиси железа в гидроокись) необходимо иметь рН воды не менее 8. Для этого в воду добавляют гашеную известь.
Из-за необходимости применения дополнительного реагента, железный купорос редко применяют на городских водопроводах.
Алюминат натрия - NaAlO2 - применяют самостоятельно или совместно с сернокислым алюминием. Алюминат натрия является щелочным реагентом, поэтому для проведения коагуляции требуется нейтрализация его щелочности, что может быть осуществлено совместным применением его с сернокислым алюминием
6NaA1О2+Аl2(S04)3+12Н3O ® 8Аl(ОН)3+3NaSO4
Степень и характер диссоциации зависит от концентрации водородных ионов (рН) в жидкой среде. Получаемые хлопья представляют собой образования неправильной формы, имеющие рыхлую сетчатую структуру и сильно развитую внутреннюю поверхность. Частицы гидроокиси покрывают поверхность более крупных частиц взвеси и слипаются друг с другом в цепочки, образуя пространственную решетку, внутри которой находится захваченная вода. На внешней и внутренней поверхности хлопья сорбированы коллоидные примеси.
Дата добавления: 2015-08-11; просмотров: 1447;
