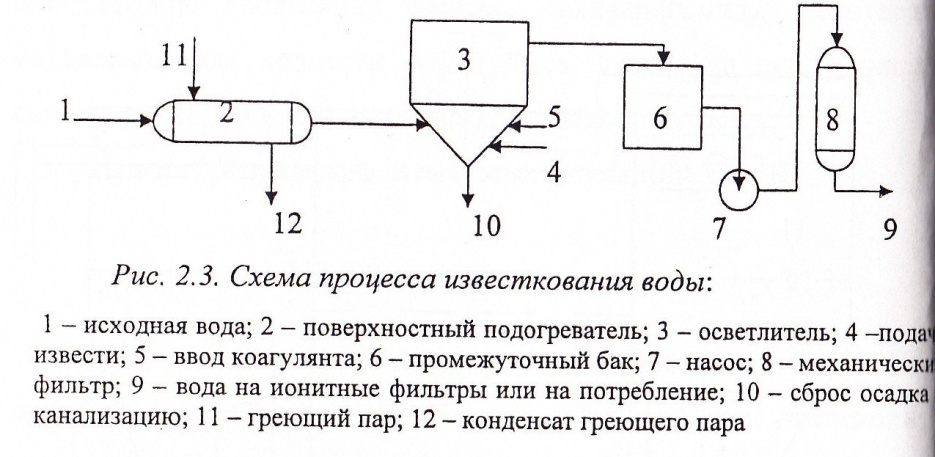
Известкование воды
Основное назначение известкования воды - это снижение щелочности (декарбонизация) исходной воды, при этом происходит соответствующее снижение жесткости и уменьшение количеств; сухого остатка. Одновременно из воды удаляются естественные механические примеси, органические загрязнения и соединения железа.
Декарбонизация воды, т.е. снижение щелочности, достигается путем увеличения рН > 9 с одновременным выводом из сферы реакции (т.е. осаждением) образующихся карбонат-ионов в составе труднорастворимого соединения СаСO3. Для этого в обрабатываемую воду вводят известь в виде раствора или суспензии, так называемого «известкового молока».
Известь предварительно гасят:
СаО+Н2О=Са(ОН)2
В результате подачи извести в обрабатываемой воде увеличивается концентрация ионов Са2+ и ОН-:

Увеличение концентрации 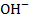 приводит к изменению существовавшего равновесия (
приводит к изменению существовавшего равновесия (  ) иобразованию молекул воды:
) иобразованию молекул воды:
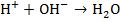
Концентрация 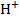 снижается, а величина рН увеличивается, что вызывает смещение углекислотного равновесия в сторону образования карбонат-ионов. При этом идут процессы:
снижается, а величина рН увеличивается, что вызывает смещение углекислотного равновесия в сторону образования карбонат-ионов. При этом идут процессы:
1) гидратация свободного СО2 и диссоциация образующихся молекул угольной кислоты:

или суммарно: 
2) диссоциация бикарбонат-ионов, ранее присутствующих в воде и обуславливающих ее щелочность:
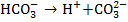
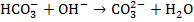
Так как концентрация карбонат-ионов увеличивается, то:
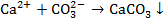
Выделение ионов  из раствора в составе осадка приводит к дальнейшей диссоциации ионов
из раствора в составе осадка приводит к дальнейшей диссоциации ионов 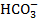 .
.
При дозирование извести в количестве большем, чем это необходимо для связывания свободной угольной кислоты и разложения бикарбонат-ионов, в воде появляется избыточная концентрация гидрокольных ионов, в результате чего гидроксид магния выпадает в осадок:
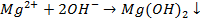
Это приводит к частичному снижению магниевой жесткости воды.
Необходимые дозы реагентов:
Кальций-ионы содержатся в исходной воде ([Са]исх), кроме того поступают в воду с дозируемой в ней известью в количестве, эквивалентном подаче ионов 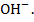
Ионы 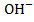 должны вводится в следующих количествах:
должны вводится в следующих количествах:
1) Для связывания свободной СO2 в количестве, эквивалентном её исходному содержанию [СO2]исх:
СO2+Н2O+2OН-->Н2СО3+2OН-
2) Для разложения бикарбонат-ионов в количестве, эквивалентном разности исходной и конечной концентрации в воде бикарбонат-ионов:
[ 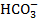 ]ИСХ — [
]ИСХ — [ 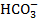 ]ОСТ
]ОСТ
Н++ 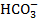 +2
+2 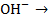 Н2O+
Н2O+ 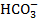 +
+ 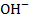
3) Для разложения коагулянта в количестве, эквивалентном дозе Д3 коагулянта :
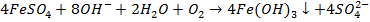
Отсюда минимальная доза извести: ДН = [СO2]ИСХ + [НСО3]ИСХ + [НСO3]ОСТ + ДК , (мг-экв/л). Общее количество ионов Са2+, содержащихся в исходной воде поступивших с известью:
[Са2+] = [Са2+]ИСХ + ДН = [Са2+]ИСХ + [С02]ИСХ + [НСО3-]ИСХ - [НС03-]ОСТ + ДК , (мг-экв/л).
Интенсификация процесса известкования:
1. Подогрев известкуемой воды:
- ускоряются процессы кристаллизации образующихся веществ
- уменьшается степень пресыщения раствора;
- остаточные концентрации приближаются к равновесным;
- улучшаются условия отделения взвеси от воды вследствие кинематической вязкости воды;
- возрастают скорости химических реакций.
2. Использование ранее выделившегося осадка в качестве контактной среды.
Обрабатываемую воду и реагенты смешивают в присутствие ранее выделившегося осадка, вводя их раздельно в нижнюю коническую часть аппарата. Движущийся в аппарате снизу вверх поток: поддерживает выделяющийся осадок во взвешенном состоянии, обтекает его частицы и контактирует с их поверхностью. Образующиеся при этом в результате обработки воды труднорастворимые вещества отлагаются на поверхности частиц контактной среды, а не выделяются в объеме обрабатываемой воды, как это происходило бы в отсутствие ранее выпавшего осадка. Излишек образующегося осадка удаляют из аппарата.
Дата добавления: 2015-08-11; просмотров: 1981;
