Показатели качества чистой воды
К физико-химическим показателям качества исходной воды, влияющим на многие процессы, протекающие в водоподготовительной установке (ВПУ), относятся:
- содержание взвешенных и органических веществ;
- содержание соединений угольной кислоты;
- жесткость;
- содержание соединений железа, меди, кремниевой кислоты;
- показатель концентрации водородных ионов рН;
- общее содержание растворенных веществ.
1. Взвешенные вещества, содержащиеся в природных водах, имеют различную степень дисперсности.
В технологии очистки воды степень дисперсности принято характеризовать так называемой гидравлической крупностью, т.е. скоростью осаждения частиц в неподвижной воде при температуре 10 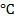 .
.
Песок:
- крупный 100 мм/с;
- средний 50 мм/с;
- мелкий 7 мм/с.
Ил 1,7 мм/с
Глина 0,005 мм/с.
Удаление взвешенных веществ достигается в процессе коагуляции воды. При отсутствии в схеме ВПУ стадии коагулирования в осветлительных фильтрах прямоточной схемы не происходит даже частичного удаления из воды веществ, находящихся в коллоидном состоянии.
2. Состав органических веществ природных вод очень разнообразен.
Основную часть составляют гуминовые вещества. Обычно незначительная доля органических примесей представлена белковоподобными соединениями, углеводами и органическими кислотами. Основным источником образования органических веществ в воде поверхностных водоемов является гумус почв и торф. Почвенный гумус обогащает воду растворимыми и коллоидными соединениями. Гуминовые вещества образуются и в самих водоемах в результате процессов разложения нестойких органических веществ до более стабильных химических соединений.
Природный гумус по физико-химическим свойствам принято условно разделять на три группы:
- гуминовые кислоты, которые в водоемах в основном присутствуют в коллоидной степени дисперсности;
- коллоидные соединения фульвокислоты;
- истинно растворенные фульвокислоты.
Элементарный состав гуминовых кислот:
- углерод (52-58) %;
- водород - (3-4) %;
- кислород - (34-39) %.
Эмпиричеcкая формула 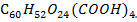
Фульвокислоты легко растворяются в воде и щелочах. Средний элементарный состав:
- углерод - 45-48 %;
- водород - 5-6 %;
- кислород - 43-48 %.
Фульвокислоты образуют с Na, К, СА, NH4+ (аммоний) и 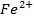 и растворимые в воде соли, соли трехвалентных катионов малорастворимы.
и растворимые в воде соли, соли трехвалентных катионов малорастворимы.
Присутствие органических веществ в природных водах обуславливает их цветность, ослабление прозрачности, иногда запах, специфический привкус. Наиболее окрашенные – гуминовые кислоты, наименее окрашенные - истинно растворенные фульвокислоты.
Окисляемость природных вод обусловлена присутствием органических веществ, поэтому ее определение - один из косвенных методов контроля содержания органических веществ в воде.
Для оценки содержащихся в воде органических загрязнений внесенных промышленными стоками, в последнее время находит применение метод угольно-хлороформного экстрагирования. Воду фильтруют через колонку с активированным углем; органические загрязнения экстрагируют хлороформом.
Наименьшей окисляемостью (2 мг О2/кг) характеризуются многие грунтовые (артезианские) воды. Окисляемостью называется расход какого-либо сильного окислителя для окисления органических примесей, которые содержатся; в одном литре воды ( 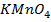 иК2Сг207 - перманентная, бихроматная окисляемость). Окисляемость речных вод колеблется в широких пределах. Высокие значения характерны для рек, бассейны которых расположены в болотистых местностях. Окисляемость поверхностных вод не является постоянной, она изменяется по сезонам года в характерных пределах для конкретного источника. Резкое повышение окисляемости воды свидетельствует о загрязнении источника промышленными и бытовыми стоками. В этом смысле окисляемость является гигиенической характеристикой воды. Органические вещества затрудняют реагентную очистку воды из-за сорбции коллоидов на частицах шламового фильтра осветлителей, препятствуя их укрупнению и осаждению. Повышенное содержание органических веществ отрицательно отражается и на работе анионитных фильтров, установок по химическому обессоливанию воды. В процессе коагулирования достигается удаление органических соединений обычно не более чем на 50 - 70%.
иК2Сг207 - перманентная, бихроматная окисляемость). Окисляемость речных вод колеблется в широких пределах. Высокие значения характерны для рек, бассейны которых расположены в болотистых местностях. Окисляемость поверхностных вод не является постоянной, она изменяется по сезонам года в характерных пределах для конкретного источника. Резкое повышение окисляемости воды свидетельствует о загрязнении источника промышленными и бытовыми стоками. В этом смысле окисляемость является гигиенической характеристикой воды. Органические вещества затрудняют реагентную очистку воды из-за сорбции коллоидов на частицах шламового фильтра осветлителей, препятствуя их укрупнению и осаждению. Повышенное содержание органических веществ отрицательно отражается и на работе анионитных фильтров, установок по химическому обессоливанию воды. В процессе коагулирования достигается удаление органических соединений обычно не более чем на 50 - 70%.
3. Водородный показатель рН:
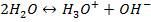 Н3О+- гидратированный протон,
Н3О+- гидратированный протон,
 (кислотные и щелочные свойства).
(кислотные и щелочные свойства).
Согласно закону действия масс в водных растворах произведение активности ионов водорода и гидроокисла ( 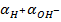 ) является постоянной, носящей название ионного произведения воды
) является постоянной, носящей название ионного произведения воды 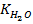 (
( 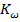 ):
):
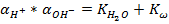
Для t = 22°С 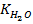 =
= 
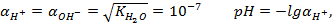
Для t = 22°С pH=7
Если в системе появляются дополнительные  за счет каких-либо процессов, это приведет к
за счет каких-либо процессов, это приведет к 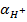 >
> 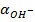 и образованию кислой среды, т.е. и рН < 7, если
и образованию кислой среды, т.е. и рН < 7, если 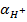 >
> 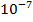 , следовательно, рН > 7 (щелочная среда). В природных водах рН = 6,5 - 8,0.
, следовательно, рН > 7 (щелочная среда). В природных водах рН = 6,5 - 8,0.
4. Соединения угольной кислоты: анионы угольной кислоты  и
и 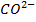 во многом определяют поведение различных примесей в природных водах и технологических процессах очистки воды.
во многом определяют поведение различных примесей в природных водах и технологических процессах очистки воды.
В природных водах одновременно присутствуют несколько форм угольной кислоты: 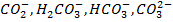
Угольная кислота диссоциирует во второй ступени:
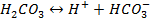
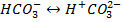
Соотношение различных форм угольной кислоты характеризуется рН воды. При рН < 4 в воде практически отсутствуют  и
и 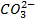 и вся кислота в форме СО2. С увеличением рН доля СО2 уменьшается и увеличивается доля
и вся кислота в форме СО2. С увеличением рН доля СО2 уменьшается и увеличивается доля 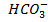 . При рН = 8,35 преобладают ионы
. При рН = 8,35 преобладают ионы 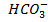 . Дальнейшее увеличение рН приводит к снижению
. Дальнейшее увеличение рН приводит к снижению 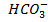 и увеличению
и увеличению 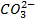 .
.
5. Щелочность воды (Щ) - сумма миллинормальных концентраций всех анионов слабых кислот и ОН" за вычетом концентрации 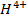 :
:
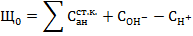
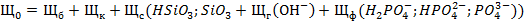
Щелочность воды обычно обусловлена присутствием в них бикарбонатов (Щб), карбонатов (Щк) и гуматов. Аналитическое определение щелочности выполняется титрированием пробы в присутствии индикаторов фенолфталеина, а затем метилоранжа или смешанного индикатора. Фенолфталеин при титровании щелочных вод дает переход окраски от розовой к бесцветной при рН = 8,2 - 8,3; метилоранж изменяет окраску от желтой к оранжевой при рН = 4,2 - 4,4; смешанный индикатор - при рН  6,0.
6,0.
Переход окраски фенолфталеина условно соответствует исчезновению в растворе иона 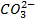 и углекислотные соединения при этом:
и углекислотные соединения при этом:  + СО2. Метилоранж меняет окраску, когда в воде условно исчезают
+ СО2. Метилоранж меняет окраску, когда в воде условно исчезают  и остается только СO2.
и остается только СO2.
При обработке воды известью ее щелочность определяется наличием в ней гидратов и карбонатов. Таким образом, щелочность и ее компоненты являются технологическими показателями процесса очистки воды.
6. Жесткость воды (ЖО) - это 1 мг-экв, соответствующий эквивалентной массе иона (Mg-20,04; Ca-12,16; Na-23,00; К-39,16  ; -61,02; С1 - 35,46;
; -61,02; С1 - 35,46; 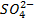 -48,00;
-48,00; 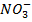 -62,01).
-62,01).
Общая жесткость воды ( ЖО) определяется суммарной концентрацией в ней катионов кальция и магния и подразделяется на карбонатную (ЖК) и некарбонатную (ЖНК).
Карбонатная жесткость обусловлена присутствием в воде бикарбонатов Са(НСО3)2 и Mg(HC03)2 - условно считают, что если содержание в воде ионов  приблизительно равняется содержанию Са2+ и Mg2+ (мг-экв/кг), то ЖК = [
приблизительно равняется содержанию Са2+ и Mg2+ (мг-экв/кг), то ЖК = [  ]:
]:
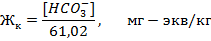
При t = 70 °С 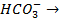 Н++
Н++ 
Некарбонатная жесткость обусловлена наличием в воде хлоридов, сульфатов и других некарбонатных солей Са и Mg (СаС12, MgCl2, CaS04: MgSO4, CaSiO3, MgSiO3 и др.).
Для случая  < Ca2+ + Mg2+, ЖНК=[Са2+ + Мg2+] - [
< Ca2+ + Mg2+, ЖНК=[Са2+ + Мg2+] - [  ].
].
Если же содержание в воде  > [Ca2+ + Mg2+], то карбонатная жесткость равна суммарному содержанию кальция и магния. Избыток
> [Ca2+ + Mg2+], то карбонатная жесткость равна суммарному содержанию кальция и магния. Избыток  обуславливается наличием в воде бикарбоната Na и Са.
обуславливается наличием в воде бикарбоната Na и Са.
Общая жесткость воды с другой стороны равна сумме концентраций в ней Са2+ (кальциевая жесткость) и Mg2+ (магниевая жесткость).
По величине ЖО природные воды классифицируют:
- ЖО < 1,5 мг-экв/л — малая жесткость;
- ЖО = 1,5 - 3,0 мг-экв/л – средняя жесткость;
- ЖО = 3,0 - 6,0 мг-экв/л – повышенная жесткость;
- ЖО = 6,0 - 12,0 мг-экв/л – высокая жесткость;
- ЖО > 12,0 мг-экв/л – очень высокая жесткость.
Жесткость является одним из наиболее важных показателей качества воды, используемым на ТЭС.
Практически во всех водоподготовительных установках ТЭС предусматривается увеличение воды Na или Н-катионированием в зависимости от условия применения очищенной воды.
7. Соединения кремниевой кислоты.
Кремниевая кислота попадает в воду при растворении различных силикатных пород. Из воды растениями поглощается около 30 - 40 мг/кг кремния, поэтому в поверхностных водах кремния меньше, чем в подземных.
Поликремниевые кислоты m*Si02 + n*H20. Соли этих кислот образуют ряд минералов, растворение которых природными водами дает кремнекислые соединения разного химического состава.
В связи с особенностью поведения кремниевой кислоты при высоких параметрах содержание ее нормируется в питательной воде котлов высокого давления. На ВПУ для котлов высокого и сверхвысокого давления предусматриваются схемы удаления кремнекислых соединений.
8. Удельная электрическая проводимость ( 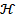 ) - электрическая проводимость кубика с размером граней 1 см (чистая вода при t = 20 °C
) - электрическая проводимость кубика с размером граней 1 см (чистая вода при t = 20 °C 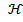 = 0,04 мкСм/см), которая характеризует содержание в воде иогенных примесей и, также как и ионное произведение воды
= 0,04 мкСм/см), которая характеризует содержание в воде иогенных примесей и, также как и ионное произведение воды 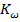 , существенно зависит от температуры.
, существенно зависит от температуры.
В воде современных энергоблоков концентрация иогенных естественных примесей (солей) мала, и обусловленная или удельная электрическая проводимость конденсата и питательной воды находится на уровне 0,1 - 0,15 мкCм/см.
9. Окислительно-восстановительный (или просто окислительный) потенциал среды еН.
Измеряют с помощью платинового электрода по отношению к стандартному водородному электроду. Данный потенциал характеризует окислительно-восстановительное равновесие в водном теплоносителе (так же как рН характеризует кислотно-щелочное). Он является важнейшим показателем, значение которого существенно влияет на ряд процессов, в частности на режим образования и растворения оксидной пленки (или железоокислых отложений) при постоянном рН.
Дата добавления: 2015-08-11; просмотров: 1597;
