Попадание примесей в воду
В соответствии с круговоротом воды в природе различают воду:
- атмосферную;
- поверхностную;
- грунтовую;
- морскую.
1. Атмосферная вода, выпадающая на земную поверхность – наиболее чистая.
Атмосферная вода содержит О2, N2 и СО2, которые поглощает из воздуха, а также органические и неорганические вещества, количество и качество которых зависит от атмосферы.
В районах больших населенных пунктов и промышленных центров атмосферная вода содержит H2S, сернистую и серную кислоты, частицы пыли и сажи. Вблизи моря в дождевых водах содержится некоторое количество растворенного NaCl.
Общее солесодержание атмосферной воды не более 50 мг/л, а содержание в ней накипеобразующих солей мало.
Использование атмосферной воды для технических целей ограничивается трудностью ее сбора в больших количествах.
2. Поверхностные, грунтовые и морские воды более минерализованы, чем атмосферная вода и, в большинстве случаев, без предварительной обработки не используются.
Поверхностные воды рек, озер и искусственных водохранилищ всегда содержат некоторое количество растворенных веществ и нерастворимых механических примесей.
Растворенными веществами вода обогащается при контакте с различными горными породами, при протекании по руслам рек и при фильтрации через грунт. Просачиваясь через верхние слои почвы, которые представляют собой мелкозернистые породы, вода освобождается от механических примесей, но одновременно обогащается солями, газами, органическими веществами, которые представляют собой продукты разложения растений и животных организмов. Происходящие в почвах процессы окисления органических веществ вызывают расход 02 и выделение НСО3 - углекислоты.
Особенно интенсивно обогащают воду осадочные породы (известняки, доломиты, мергели, гипс, каменная соль и т.д.). Подпочвенными водами легче всего растворяются NaCl, Na2SO4, MgSO4 и другие легкорастворимые соли.
Обогащение природных вод труднорастворимыми карбонатами кальция СаСO3, магния MgCO3 и железа FeCO3 происходит по следующим химическим реакциям:
СаС03+Н20+С02 Са(НС03)2 Са2++ 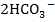
MgCO3+H2O+CO2 Mg(HCO3)2 Mg2++ 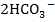
FeCO3+H2O+C02 Fe(HC03)2 Fe2++ 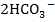
В результате этих реакций образуются легкорастворимые в воде двууглекислые соединения - бикарбонаты Са, Mg и Fe, диссоциирующие на анионы 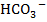 и катионы Са2+, Mg2+ и Fe2+. Так как углекислые соли Са и Mg (CaCO3 и MgCO3) встречаются очень часто в различных породах (известняки, меловые отложения, доломиты), то бикарбонаты Са и Mg содержатся почти во всех природных водах.
и катионы Са2+, Mg2+ и Fe2+. Так как углекислые соли Са и Mg (CaCO3 и MgCO3) встречаются очень часто в различных породах (известняки, меловые отложения, доломиты), то бикарбонаты Са и Mg содержатся почти во всех природных водах.
Коренные горные породы, представляющие собой сложные силикаты и алюмосиликаты (гранит, кварцевые породы и т.д.), почти нерастворимы в воде. Лишь длительное воздействие на них воды, содержащей органические кислоты, разрушает эти горные породы, и образуются растворимые в воде силикаты.
Подземные воды, выходящие на поверхность из артезианских скважин, родников и ключей (ручьев),называются грунтовыми.
Грунтовые воды обычно прозрачные, практически не содержат механических примесей и коллоидных веществ, от которых они освободились при фильтрации через грунт. Но при прохождении через грунт вода насыщается различными растворимыми веществами, из-за чего солесодержание грунтовых вод выше, чем поверхностных.
Из природных вод наиболее минерализованные - воды океанов, открытых морей и соленых озер.
Кроме естественного кругооборота воды есть также искусственный, созданный жизнедеятельностью людей: вода из источников водоснабжения забирается насосами промышленных и коммунальных водопроводов, затем подается по трубам для употребления, в результате чего, как правило, ухудшается ее качество.
После этого сточные воды спускаются в водоемы, иногда после предварительной очистки, но чаще без всякой очистки. В результате этого многие реки сильно загрязняются промышленными и бытовыми стоками. Загрязненная вода вновь забирается низлежащими водоприемниками и т.д. При дефиците воды такой круговорот иногда замыкается внутри одного предприятия.
С промышленными сточными водами фабрик, заводов, рудников и коммунальных предприятий в источники водоснабжения могут попадать свободные кислоты и щелочи, соединения меди, свинца, цинка, алюминия, а также фенолы, эфирные масла, нефтепродукты. В сточных водах населенных пунктов присутствуют продукты разложения белков: амины, аммиак, сероводород и т.д. Такие стоки иногда радикально меняют состав воды в водоемах; например в случае химических, коксобензольных, нефтеперегонных и других заводов.
Степень загрязнения реки зависит от количества сточных вод, спускаемых в реку, живого сечения реки, скорости ее течения и величины самоочищающего действия реки - взвешенные вещества постепенно осаждаются на дно, а органические вещества, окисляясь, переходят в газообразное состояние. В оздоровлении реки большую роль играют биологические процессы, основанные на жизнедеятельности растительных и животных организмов.
При использовании на ТЭС воды из загрязненных рек нужна ее сложная обработка. Это требует дополнительных затрат, ухудшает эксплуатацию оборудования и снижает экономичность работы электростанции. Поэтому охрана водоемов и рек от загрязнения является важной народно-хозяйственной задачей, разрешение которой требует проведения хорошей предварительной очистки всех сточных вод перед спуском их в источник водоснабжения.
Дата добавления: 2015-08-11; просмотров: 1220;
