Уравнение состояния реальных газов
В реальных газах в отличие от идеальных существенны силы межмолекулярных взаимодействий и нельзя пренебречь собственным объемом молекул.
Силы межмолекулярных взаимодействий в себя включают:
1) Силы притяжения, когда молекулы находятся на значительном расстоянии;
2) Силы отталкивания при достаточном сближении молекул друг с другом.
Наличие межмолекулярных сил отталкивания приводит к тому, что молекулы могут сближаться между собой только до некоторого минимального расстояния. Поэтому можно считать, что свободный для движения молекул объем будет равен v-b, где b – тот наименьший объем, до которого можно сжать газ. В соответствии с этим длина свободного пробега молекул уменьшается, и давление увеличивается по сравнению с идеальным газом в отношении v/(v-b), т.е.
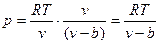 .
.
Силы притяжения действуют в том же направлении, что и внешнее давление, и приводят к возникновению молекулярного (или внутреннего) давления. Сила молекулярного притяжения каких-либо двух малых частей газа пропорциональна произведению числа молекул в каждой из этих частей (квадрату плотности). Соответственно молекулярное давление обратно пропорционально квадрату удельного объема газа:
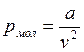 ,
,
где а – коэффициент пропорциональности, зависящий от природы газа.
Отсюда получаем уравнение Ван-дер-Ваальса (1873 г.):
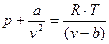 , (1.6)
, (1.6)
При больших удельных объемах и сравнительно невысоких давлениях реального газа уравнение Ван-дер-Ваальса практически вырождается в уравнение состояния идеального газа Клапейрона. Ибо величина 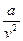 (по сравнению с р) и b (по сравнению с v) становятся пренебрежимо малыми. Состояние идеального газа – это предельное состояние реального газа, когда давление стремится к нулю.
(по сравнению с р) и b (по сравнению с v) становятся пренебрежимо малыми. Состояние идеального газа – это предельное состояние реального газа, когда давление стремится к нулю.
Дата добавления: 2015-08-11; просмотров: 803;
