Уравнение состояния идеальных газов. Идеальными газами называют такие, которые полностью подчиняются законам Бойля-Мариотта и Гей-Люссака
Идеальными газами называют такие, которые полностью подчиняются законам Бойля-Мариотта и Гей-Люссака. В идеальных газах отсутствуют силы взаимного притяжения и отталкивания между молекулами, а объем самих молекул пренебрежимо мал по сравнению с объемом газа.
Из уравнений (1.3) и (1.4) следует, что 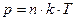 .
.
Рассмотрим 1 кг газа. Учитывая, что в нем содержится N молекул и, следовательно, 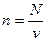 , получим:
, получим: 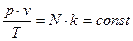 .
.
Постоянную величину 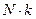 , отнесенную к 1 кг газа, обозначают буквой R и называют газовой постоянной. Поэтому
, отнесенную к 1 кг газа, обозначают буквой R и называют газовой постоянной. Поэтому 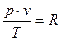 или
или
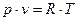 . (1.5)
. (1.5)
Полученное соотношение представляет собой уравнение Клапейрона (1834 г.).
Умножив полученное уравнение на М, получим уравнение состояния для произвольной массы газа М:
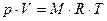 .
.
Уравнению Клапейрона можно придать универсальную форму, если отнести газовую постоянную к 1 кмолю газа, т.е. к количеству газа, масса которого в килограммах численно равна молекулярной массе μ. Соответственно М= μ и V=V μ, получим для одного моля уравнение Клапейрона-Менделеева:
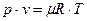 ,
,
где V μ – объем киломоля газа;
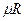 - универсальная газовая постоянная,
- универсальная газовая постоянная, 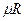 =8314
=8314 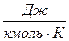 - для идеальных газов при нормальных физических условиях.
- для идеальных газов при нормальных физических условиях.
Газовая постоянная 1 кг газа составляет:
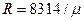 .
.
Значения удельной газовой постоянной R , 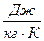 , для различных газов: кислород - 259,8; воздух – 287,0; водяной пар – 461,6.
, для различных газов: кислород - 259,8; воздух – 287,0; водяной пар – 461,6.
Дата добавления: 2015-08-11; просмотров: 724;
