Структуры белка
Получены доказательства предположения К. Линдерстрёма-Ланга о существовании 4 уровней структурной организации белковой молекулы: первичной, вторичной, третичной и четвертичной структуры. Техника современной белковой химии разработана настолько хорошо, что позволяет в принципе расшифровать структурную организацию любого белка.
Первичная структура белка. К настоящему времени расшифрована первичная структура десятков тысяч разных белков, что является несомненным достижением биохимии. Однако это число ничтожно мало, если учесть, что в природе около 1012 разнообразных белков. Под первичной структурой подразумевают порядок, последовательность расположения аминокислотных остатков в полипептидной цепи. Зная первичную структуру, местоположение каждого остатка аминокислоты, можно точно написать структурную формулу белковой молекулы, если она представлена одной полипептидной цепью.
Для определения первичной структуры полипептидной цепи в первую очередь методами гидролиза выясняют аминокислотный состав, точнее, соотношение каждой из 20 аминокислот в образце гомогенного полипептида. Затем приступают к определению химической природы концевых аминокислот полипептидной цепи, содержащей одну свободную NH2-группу и одну свободную СООН-группу.
Методы определения N-концевой аминокислоты. Для определения природы N-концевой аминокислоты предложен ряд методов, в частности метод Сэнджера (F. Sanger), основанный на реакции арилирования полипептида 2,4-динитрофторбензолом (ДНФБ), что приводит к образованию окрашенного в желтый цвет 2,4-динитрофенильного производного N-концевой аминокислоты. Раствор полипептида обрабатывают ДНФБ, который взаимодействует со свободной NH2-группой N-концевой аминокислоты пептида.
Определение N-концевой аминокислоты методом Сенджера
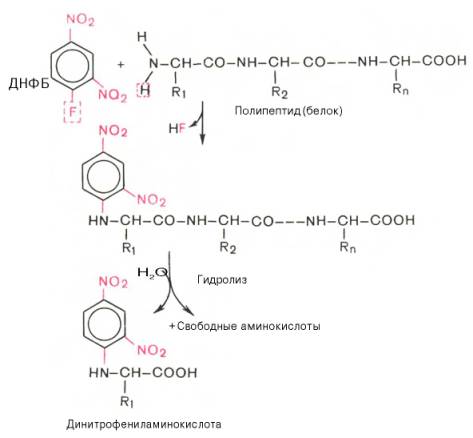
После кислотного гидролиза продукта реакции – динитрофенилпептида только одна N-концевая аминокислота оказывается связанной с реактивом в виде 2,4-динитрофениламинокислоты (стабильной при гидролизе). В отличие от других образовавшихся при гидролизе полипептида свободных аминокислот она желтого цвета. Ее идентифицируют методом хроматографии.
Для определения N-концевой аминокислоты значительно более широко применяется фенилтиогидантоиновый метод Эдмана благодаря своей высокой чувствительности и возможности многократного использования в одной и той же пробе. Фенилизотиоцианат реагирует со свободной α-NH2-группой N-концевой аминокислоты полипептида с образованием фенилтиокарбамоил-пептида.
Определение N-концевой аминокислоты методом Эдмана

Обработка продукта реакции кислотой приводит к циклизации и освобождению фенилтиогидантоина N-концевой аминокислоты, природу которого устанавливают хроматографически. Укороченный на одну аминокислоту полипептид подвергают дальнейшему анализу.
Эту процедуру ступенчатого расщепления пептида с N-конца можно повторять многократно, идентифицируя последовательно одну аминокислоту за другой. Метод Эдмана используется в качестве химической основы для определения первичной структуры белков и пептидов. Он реализован в специальном приборе – секвенаторе (от англ. sequence – последовательность), работающем в автоматическом режиме и позволяющем определить последовательность аминокислот с N-конца пептида до 50–60 аминокислотных остатков.
Для этих же целей иногда применяют ферменты экзопептидазы, в частности аланин- и лейцинаминопептидазу. Эти ферменты разрывают пептидные связи с того конца полипептида, где имеется свободная NН2-группа, освобождая N-концевую аминокислоту.
Методы определения С-концевой аминокислоты. Для определения природы С-концевой аминокислоты часто используют ферментативные методы. Обработка полипептида карбоксипептидазой, которая разрывает пептидную связь с того конца пептида, где содержится свободная СООН-группа, приводит к освобождению С-концевой аминокислоты, природа которой может быть идентифицирована методом хроматографии.
Предложен также химический метод С. Акабори, который основан на гидразинолизе полипептида:
Определение С-концевой аминокислоты методом Акабори
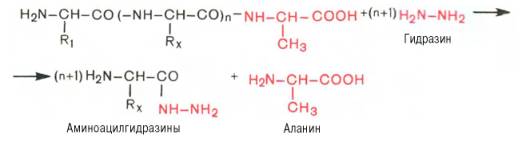
Гидразин, вызывая распад чувствительных к нему пептидных связей полипептида, реагирует со всеми аминокислотами, за исключением С-концевой аминокислоты, поскольку ее карбоксильная группа не участвует в образовании пептидной связи. При этом образуется смесь аминоацилгидразинов и свободной С-концевой аминокислоты. Последнюю после обработки всей смеси ДНФБ отделяют и идентифицируют хроматографически, для чего образовавшиеся динитрофенилпроизводные аминоацилгидразинов предварительно экстрагируют уксусно-этиловым эфиром.
С-концевую аминокислоту идентифицируют также путем обработки полипептида восстанавливающим агентом, например боргидридом натрия. В простейшей форме эту процедуру можно представить в следующем виде:
Определение С-концевой аминокислоты боргидридом натрия
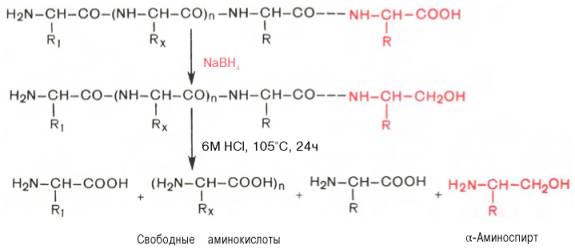
Видно, что в указанных условиях только одна, а именно С-концевая, аминокислота будет превращаться в α-аминоспирт, легко идентифицируемый методом хроматографии. Таким образом, при помощи указанных методов определяют природу N- и С-концевых аминокислот.
Следующий этап работы связан с определением чередования (последовательности) аминокислот внутри полипептидной цепи. Для этого сначала проводят избирательный, частичный (химический и ферментативный), гидролиз полипептидной цепи на короткие пептидные фрагменты, последовательность аминокислот в которых может быть точно определена описанными ранее методами.
Ферментативные методы гидролиза основаны на избирательности действия протеолитических (вызывающих распад белков) ферментов, расщепляющих пептидные связи, образованные определенными аминокислотами. В частности, пепсин ускоряет гидролиз связей, образованных остатками фенилаланина, тирозина и глутаминовой кислоты, трипсин – аргинина и лизина, химотрипсин – триптофана, тирозина и фенилаланина. В результате полипептидная цепь расщепляется на мелкие пептиды, содержащие иногда всего несколько аминокислот, которые отделяют друг от друга сочетанными электрофоретическими и хроматографическими методами, получая своеобразные пептидные карты. Далее определяют чередование аминокислот в каждом индивидуальном пептиде. Завершается работа воссозданием первичной структуры полной полипептидной цепи на основании определения последовательности аминокислот в отдельных пептидах.
Дальнейшие задачи – установление последовательности расположения аминокислот в каждом из выделенных пептидов, сопоставление полученных данных и установление первичной структуры всей молекулы.
В настоящее время выяснение первичной структуры белков является вопросом времени и технического оснащения лабораторий. Полностью выяснена первичная структура многих природных белков и прежде всего инсулина, содержащего 51 аминокислотный остаток (Сэнджер Ф., 1954). Более крупным белком с выясненной первичной структурой оказался иммуноглобулин, в четырех полипептидных цепях которого насчитывается 1300 аминокислотных остатков. За эту работу Дж. Эдельман и Р. Портер были удостоены Нобелевской премии (1972).
Расшифрованы первичные структуры миоглобина человека (153 аминокислотных остатка), α-цепи (141) и β-цепи (146) гемоглобина человека, цитохрома С из сердечной мышцы человека (104), лизоцима молока человека (130), химотрипсиногена быка (245) и многих других белков, в том числе ферментов и токсинов. Молекула инсулина, состоящая из двух цепей (А – 21 и В – 30 аминокислотных остатков), образуется из своего предшественника – проинсулина (84 аминокислотных остатка), представленного одной полипептидной цепью, после отщепления от него пептида, состоящего из 33 аминокислотных остатков. Между цепями А и В и внутри А-цепи инсулина образуются дисульфидные (—S—S—) связи. Выяснена первичная структура более 18 инсулинов, выделенных из разных источников. Близкими по первичной структуре оказались инсулины из поджелудочной железы человека, свиньи и кашалота. Единственным отличием инсулина человека является нахождение треонина в положении 30 В-цепи вместо аланина.
Вторым белком, первичная структура которого расшифрована С. Муром и У. Стейном, является рибонуклеаза из поджелудочной железы, катализирующая расщепление РНК. Фермент состоит из 124 аминокислотных остатков с N-концевым лизином и С-концевым валином, между остатками цистеина образуются дисульфидные (—S—S—) связи в 4 участках.
Полностью расшифрована последовательность аминокислот полипептидной цепи фермента лизоцима, имеющего важное защитное и медицинское значение, так как он вызывает лизис ряда бактерий, расщепляя основное вещество их клеточной оболочки. Лизоцим белка куриного яйца содержит 129 аминокислот с N-концевым лизином и С-концевым лейцином.
Отечественными исследователями установлена первичная структура многих белков и полипептидов, в том числе крупного белка РНК-полимеразы, фермента аспартатаминотрансферазы, состоящей из 412 аминокислотных остатков (А.Е. Браунштейн, Ю.А. Овчинников и др.), пепсиногена и пепсина (В.М. Степанов и др.), и др.
Исследования первичной структуры α- и β-цепей гемоглобина способствовали выяснению структуры необычных, так называемых аномальных, гемоглобинов, встречающихся в крови больных гемоглобинопатиями. Иногда развитие болезни, как и изменение пространственной структуры гемоглобина человека, обусловлено заменой лишь одной какой-либо аминокислоты в структуре β-цепей (реже α-цепей) гемоглобина.
Анализ данных о первичной структуре белков позволяет сделать следующие общие выводы.
1 Первичная структура белков уникальна. Каждый индивидуальный гомогенный белок характеризуется уникальной последовательностью аминокислот: частота замены аминокислот приводит не только к структурным перестройкам, но и к изменениям физико-химических свойств и биологических функций.
2 Стабильность первичной структуры обеспечивается в основном пептидными связями; возможно участие дисульфидных связей.
3 В полипептидной цепи могут быть обнаружены разнообразные комбинации аминокислот; в полипептидах относительно редки повторяющиеся последовательности.
4 В некоторых ферментах, обладающих близкими каталитическими свойствами, встречаются идентичные пептидные структуры, содержащие неизменные (инвариантные) участки и вариабельные последовательности аминокислот, особенно в областях их активных центров.
5 В первичной структуре полипептидной цепи детерминированы вторичная, третичная и четвертичная структуры белковой молекулы, определяющие ее общую пространственную конформацию.
Вторичная структура белка. Под вторичной структурой белка подразумевают конфигурацию полипептидной цепи, т. е. способ свертывания, скручивания (складывание, упаковка) полипептидной цепи в спиральную или какую-либо другую конформацию. Процесс этот протекает не хаотично, а в соответствии с программой, заложенной в первичной структуре. Подробно изучены две основные конфигурации полипептидных цепей, отвечающих структурным требованиям и экспериментальным данным: α-спирали и β-структуры.
Благодаря исследованиям Л. Полинга наиболее вероятным типом строения глобулярных белков принято считать α-спираль (рис. 1). Закручивание полипептидной цепи происходит по часовой стрелке (правый ход спирали), что обусловлено L-аминокислотным составом природных белков. Движущей силой в возникновении α-спиралей (так же как и β-структур) является способность аминокислот к образованию водородных связей. В структуре α-спиралей открыт ряд закономерностей. На каждый виток (шаг) спирали приходится 3,6 аминокислотных остатка. Шаг спирали (расстояние вдоль оси) равен 0,54 нм на виток, через 5 витков спирали (18 аминокислотных остатков) структурная конфигурация полипептидной цепи повторяется. Это означает, что период повторяемости (или идентичности) α-спиральной структуры составляет 2,7 нм.
Не все глобулярные белки спирализованы на всем протяжении полипептидной цепи. В молекуле белка α-спиральные участки чередуются с линейными. В частности, если α- и β-цепи гемоглобина спирализованы, например, на 75%, то лизоцима – на 42%, а пепсина – всего на 30%
.
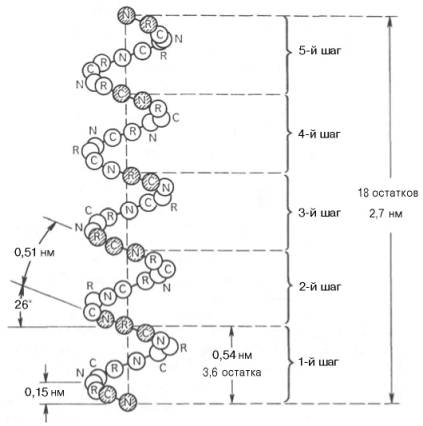
Рисунок 1 -Структура и параметры α-спирали
Таким образом, стабильность вторичной структуры обеспечивается в основном водородными связями (определенный вклад вносят и главновалентные связи – пептидные и дисульфидные).
В белковой молекуле наиболее важные водородные связи образуются между ковалентно связанным атомом водорода, несущим частичный положительный заряд, и отрицательно заряженным ковалентно связанным атомом кислорода (рис. 2). Примеры водородных связей в белковой молекуле: а) между пептидными цепями; б) между двумя гидроксильными группами; в) между ионизированной СООН-группой и ОН-группой тирозина; г) между ОН-группой серина и пептидной связью.
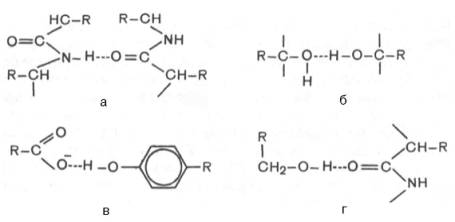
Рисунок 2 - Образование водородной связи
Другой тип конфигурации полипептидных цепей, обнаруженный в белках волос, шелка, мышц и в других фибриллярных белках, получил название β-структуры. В этом случае две или более линейные полипептидные цепи, расположенные параллельно или, чаще, антипараллельно, прочно связываются межцепочечными водородными связями между NH-и СО-группами соседних цепей, образуя структуру типа складчатого слоя (рис. 3).
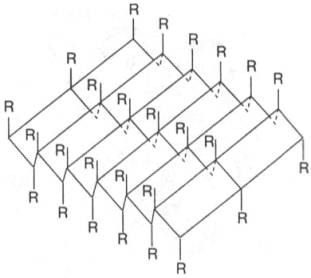
Рисунок 3 -β-Структура полипептидных цепей
В природе существуют белки, строение которых, однако, не соответствует ни β-, ни α-структуре. Типичным примером таких белков является коллаген – фибриллярный белок, составляющий основную массу соединительной ткани в организме человека и животных.
Методами рентгеноструктурного анализа в настоящее время доказано существование еще двух уровней структурной организации белковой молекулы, оказавшихся промежуточными между вторичной и третичной структурами. Это так называемые надвторичные структуры и структурные домены. Домен – это компактная глобулярная структурная единица внутри полипептидной цепи. Домены могут выполнять разные функции. Открыто много белков (например, иммуноглобулины), состоящих из разных по структуре и функциям доменов, кодируемых разными генами.
Третичная структура белка. Под третичной структурой белка подразумевают пространственную ориентацию полипептидной спирали или способ укладки полипептидной цепи в определенном объеме.
Первым белком, третичная структура которого была выяснена Дж. Кендрью на основании рентгеноструктурного анализа, оказался миоглобин кашалота. Это сравнительно небольшой белок с М 16700, содержащий 153 аминокислотных остатка, представленный одной полипептидной цепью в виде изогнутой трубки, компактно уложенной вокруг гема (небелковый компонент, содержащий железо) (рис. 4).
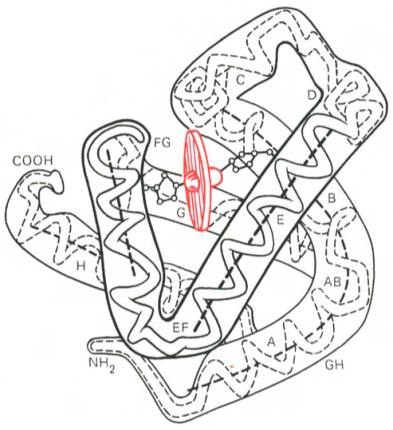
| Рисунок 4 - Модель третичной структуры молекулы миоглобина. Латинскими буквами обозначены структурные домены, красным цветом - ген |
Основная функция миоглобина – перенос кислорода в мышцах.
В настоящее время получены доказательства, что в стабилизации пространственной структуры белков, помимо ковалентных связей (пептидные и дисульфидные связи), основную роль играют так называемые нековалентные связи. К этим связям относятся водородные связи, электростатические взаимодействия заряженных групп, межмолекулярные ван-дер-ваальсовы силы, взаимодействия неполярных боковых радикалов аминокислот, так называемые гидрофобные взаимодействия и т.д.
Третичная структура белка после завершения его синтеза в рибосомах формируется автоматически самопроизвольно при взаимодействии радикалов аминокислот с молекулами воды, и полностью предопределяется первичной структурой.
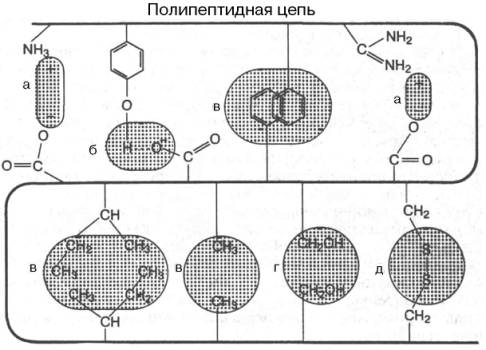
а - электростатическое взаимодействие; б - водородная связь; в - гидрофобные взаимодействия неполярных групп; г - диполь-дипольные взаимодействия; д - дисульфидная (ковалентная) связь
Рисунок 5-Типы нековалентных связей, стабилизирующих третичную структуру белка
Четвертичная структура белка.Под четвертичной структурой подразумевают способ укладки в пространстве отдельных полипептидных цепей, обладающих одинаковой (или разной) первичной, вторичной или третичной структурой, и формирование единого в структурном и функциональном отношениях макромолекулярного образования. Многие функциональные белки состоят из нескольких полипептидных цепей, соединенных валентными связями, а нековалентными (аналогичными тем, которые обеспечивают стабильность третичной структуры). Каждая отдельно взятая полипептидная цепь, получившая название протомера, мономера или субъединицы, чаще всего не обладает биологической активностью. Эту способность белок приобретает при определенном способе пространственного объединения входящих в его состав протомеров, т.е. возникает новое качество, не свойственное мономерному белку. Образовавшуюся молекулу принято называть олигомером (или мультимером).
Олигомерные белки чаще построены из четного числа протомеров (от 2 до 4, реже от 6 до 8) с одинаковыми или разными молекулярными массами – от нескольких тысяч до сотен тысяч. В частности, молекула гемоглобина состоит
из двух одинаковых α- и двух β- полипептидных цепей, т.е. представляет собой тетрамер. Молекула гемоглобина содержит четыре полипептидные цепи, каждая из которых окружает группу гема – пигмента, придающего крови ее характерный красный цвет.
Все биологические свойства белков (каталитические, гормональные, антигенные и др.) связаны с сохранностью их третичной структуры, которую принято называть нативной конформацией. Любые воздействия (термические, физические, химические), приводящие к нарушению этой конформации молекулы (разрыв водородных и других нековалентных связей), сопровождаются частичной или полной потерей белком его биологических свойств.
Основными силами, стабилизирующими четвертичную структуру, являются нековалентные связи между протомерами, которые взаимодействуют друг с другом по типу комплементарности – универсальному принципу, свойственному живой природе.
Таким образом, имеются все основания для подтверждения мнения о существовании 4 уровней структурной организации белков. Поэтому выяснение структуры разнообразных белков может служить ключом к познанию природы живых систем. На этом пути научного поиска могут быть решены также многие проблемы наследственных заболеваний человека, в основе которых лежат дефекты структуры и биосинтеза белков.
Некоторые исследователи склонны рассматривать существование пятого уровня структурной организации белков. Это полифункциональные макромолекулярные комплексы, или ассоциаты из разных ферментов, получивших название метаболонов, и катализирующих весь путь превращений субстрата (синтетазы высших жирных кислот, пируватдегидрогеназный комплекс, дыхательная цепь).
Дата добавления: 2015-08-11; просмотров: 4994;
