Учебный вопрос № 4. Построение диаграммы S – Т.
Тепловые процессы, происходящие при охлаждении и нагревании воздуха или других газов (паров), удобно изучать, пользуясь так называемой энтропийной диаграммой, по которой можно легко находить все основные величины, характеризующие тепловое состояние вещества. Эта диаграмма называется S–Т-диаграммой, т.к. по горизонтальной ее оси отложены значения энтропии S, а по вертикали – абсолютные температуры Т.
Горизонтальные прямые на диаграмме соответствуют процессам, протекающим при постоянной температуре (изотермические). Линии, изображающие процессы на диаграмме, называют изотермами.
Вертикальные прямые на диаграмме соответствуют обратимым процессам, протекающим при неизменной энтропии (без подвода и отвода тепла – адиабатическим). Линии, изображающие процессы на диаграмме, называются адиабатами.
Кривые линии, идущие на диаграмме сверху вниз, соответствующие процессам при постоянном давлении, называют изобарами.
Кривые постоянной энтальпии (изоэнтальпии) показаны на диаграмме линиями, идущими слева направо с некоторым уклоном вниз.
| Т Т2V=const 2 Т" Нагрев q Т´ Т1 Рис. 2. Изохора (V=const) |
| Охлаждение |
| q |
| 3 4 S |
Процесс V-const. Построение изохоры (рис. 2) можно осуществить из уравнения ΔS = (S2 – S1)V = 2,3СV lg(Т2/Т1). Задаваясь различными конечными температурами Т2 (а начальная температура Т1 предполагается известной), подсчитываем теплоемкость при постоянном объеме для данного рабочего тела СV в известном интервале температур величину lg (Т2/Т1) и определяем изменение энтропии ΔS = (S2 – S1)V. Наносим отдельные точки на S–Т диаграмму и соединяем их между собой. В результате получаем кривую изохорного процесса, которая является логарифмической кривой. Площадь 1-2-3-4 под кривой процесса представляет собой величину подведенного или отведенного тепла.
Процесс Р-const. Для построения изобары (рис. 3) пользуемся уравнением ΔS = (S2 – S1)Р = 2,3СР lg(Т2/Т1). Задаваясь, как и ранее, различными значениями температур Т2, находим теплоемкость СР при постоянном давлении и определяем отдельные точки процесса, по которым строим логарифмическую кривую.
Площадь 1-2-3-4 под кривой представляет собой величину подведенной теплоты при процессе расширения газа, протекающего, как известно, с ростом температуры или отведенной теплоты при процессе охлаждения газа (или выталкивании). При расширении (нагревании) ΔS увеличивается, при охлаждении (выталкивании) ΔS уменьшается.
| Расширение |
| Сжатие |
| V=const |
| P=const |
| Δ SV |
| Δ SР |
Т2 2V 2Р
q
1 2
Т1 1 qT
qVqP
3 4 5 3 4 S
Рис. 4. Изотерма (Т=const)
Рис. 3. К построению процессов V=const
и P=const
Изохора располагается круче изобары, т.к. при одинаковом изменении температур для обоих процессов ΔSР >ΔSV в k раз.

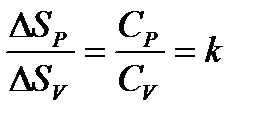 ΔSР = k ΔSV
ΔSР = k ΔSV
Площадь, расположенная под кривой V=const (1-2V-4-3), соответствует расходу теплоты qV = СV (Т2 -Т1).
Аналогично площадь, расположенная под кривой Р=const (1-2Р-5-3), соответствует расходу теплоты qP = СР (Т2 -Т1).
Разность этих площадей, соответствующая площади, расположенной между процессами, будет равна работе газа, совершаемой в процессе
qP -qV = СР (Т2 -Т1) - СV (Т2 -Т1)=(СР –СV) (Т2 -Т1)= АR(Т2 -Т1)=АlР.
Процесс Т-const. В этом случае наиболее простыми выражениями будут:
ΔSТ = (S2 – S1)Т = 2,3 АR lg 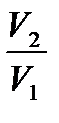 ; ΔSТ = (S2 – S1)Т = 2,3 АR lg
; ΔSТ = (S2 – S1)Т = 2,3 АR lg 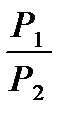 .
.
Эти выражения имеют одинаковую силу, так как 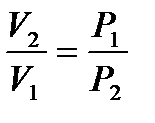 .
.
На S-Т диаграмме изотерма представит собой горизонтальную линию, параллельную оси S. Площадь1-2-3-4 под кривой процесса соответствует количеству подведенной (при расширении) теплоты. С подводом тепла ΔS увеличивается. Значит, направление процесса слева направо отвечает расширению газа, а справа налево – сжатию (с отводом тепла).
Процесс Δq=0 (адиабатический). Из уравнения
ΔSq=0 = (S2 – S1)q=0 = 2,3СPlg(V1/V2)- 2,3СVlg(V1/V2)=2,3(СР–СV) lg(V1/V2)
| Т S Рис. 5. Адиабата (Δq=0). |
| отсутствует (Δq=0). При движении вверх имеет место повышение температуры, а это, в свою очередь, означает уменьшение объема, т.е. протекает процесс сжатия. При движении вниз будем иметь расширение. Интересно отметить, что графики термодинамических процессов, которые в диаграмме Р-V изображаются кривыми линиями (изотерма, адиабата), в S-Т диаграмме оказываются прямыми, и наоборот, те из них, которые представляются в Р-V диаграмме прямыми линиями (изобара, изохора), в S-Т диаграмме являются криволинейными. |
  |
S-Т диаграмма рабочих тел дает возможность, не прибегая к сложному аналитическому расчету, легко и достаточно быстро определять требуемые параметры, а также (что значительно важнее) изображать и рассчитывать процессы и циклы различных тепловых устройств.
Дата добавления: 2015-08-11; просмотров: 969;
