Тема 11. Уравнение состояния идеального газа.
Состояние системы задаетсятермодинамическими параметрами – совокупностью физических величин, характеризующих свойства термодинамической системы, например, давлением р, объемом V и температурой Т. Между этими параметрами существует определенная связь, называемаяуравнением состояния, которое имеет общий вид:
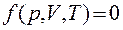 ,
,
где каждая из переменных является функцией двух других.
Для идеального газа уравнением состояния является уравнение Клапейрона – Менделеева:
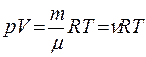 ,
,
где m – масса газа, 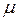 – молярная масса (масса одного моля вещества),
– молярная масса (масса одного моля вещества),
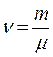 – количество вещества,
– количество вещества,
R – универсальная газовая постоянная,  .
.
(Идеальнымназывается такой газ, в котором считается, что собственный объем молекул газа пренебрежимо мал по сравнению с объемом сосуда, в котором он находится, силы взаимодействия между молекулами газа отсутствуют, а столкновения между молекулами газа абсолютно упругие.)
Исходя из уравнения Клапейрона – Менделеева и понятия концентрации n (n – число молекул в единице объема:  , где N – число всех молекул газа), можно получить уравнение состояния идеального газа в ином виде:
, где N – число всех молекул газа), можно получить уравнение состояния идеального газа в ином виде:
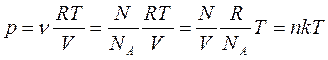 , то есть
, то есть 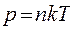 ,
,
где 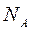 – постоянная Авогадро – число молекул в одном моле вещества,
– постоянная Авогадро – число молекул в одном моле вещества,
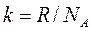 ,
, 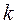 – постоянная Больцмана.
– постоянная Больцмана.
Дата добавления: 2015-08-08; просмотров: 582;
