Ионный состав
Ионный состав культуральных сред может сильно варьировать. Первые среды длякультивирования ооцитов и эмбрионов млекопитающих представляли собоймодификацию раствора Кребса. Они содержали ионы, необходимые для поддержанияжизни клеток – Na+, К+, Са2+, Mg2+, 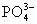 и
и 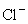 , растворенные вбикарбонатном буфере (НCO3). Также добавлялись антибиотики дляпредотвращения бактериального заражения и источник белка в форме альбумина илисыворотки. Наиболее часто в качестве источника белка используется бычий иличеловеческий сывороточный альбумин, а также инактивированная человеческаясыворотка. Примерами таких сред могут служить Ml6, Т6, HTF (человеческаятрубная жидкость), EBSS (сбалансированный солевой раствор Эрла) и др. Болеесложные по составу среды, такие, как Ham's F10 и F12, aМЕМ, М199, хотя и былиразработаны для тканевых культур, но могут использоваться и для культивированияэмбрионов различных видов млекопитающих.Энергетическими субстратами для ооцитов и эмбрионов млекопитающих вкультуральной среде обычно служат пируват, лактат и глюкоза, причемусвоение глюкозы эмбрионы человека начинают лишь до прошествии несколькихклеточных делений, а до этого предпочтительным источником энергии служитпируват.Добавление аминокислот во многие культуральные среды объясняется ихприсутствием в жидкости яйцеводов многих видов млекопитающих. Было показано,что добавление глутамина в культуральную среду оказывает положительноевлияние на развитие эмбрионов многих видов млекопитающих. Однако привведении в среду аминокислот надо иметь в виду, что не все они остаютсястабильны в условиях культивирования – при температуре 37С многие из нихразрушаются, образуя аммоний, который при накоплении в среде обладаеттоксическим эффектом.Специально для культивирования эмбрионов Menezo с соавт. была разработанасреда В2, гораздо более сложная по составу: помимо солей, она содержитаминокислоты, витамины, нуклеотиды, микроэлементы и - в ряде случаев – дажежирные кислоты. Все эти среды применяются в практике ЭКО в различныхлабораториях. При том, что роль многих компонентов сложных сред до сих порне была убедительно показана, их применение дает хорошие результаты. CO2-ИНКУБАТОР Культивирование ооцитов и эмбрионов человека проводится в присутствии 5% CO3 в воздухе при температуре 37±0,1 °С и влажности 80 – 90%. Эти условиясоблюдаются при использовании CO3-инкубаторов, поддерживающихнеобходимую температуру, влажность и уровень CO2 в камере.Последний параметр поддерживается посредством подачи углекислого газа избаллона, где он находится в сжиженном состоянии, и воздуха из окружающей среды.Углекислый газ для культивирования должен соответствовать медицинскимстандартам по чистоте. В некоторых клиниках применяется готовая газовая смесь, содержащая углекислый газ, азот и кислород в нужной пропорции. Влажность в камере CO3-инкубаторов поддерживается постояннымиспарением воды со дна камеры либо из специального лотка. Также в некоторыхсовременных инкубаторах имеется система инжекции воды в циркулирующий воздух,позволяющая автоматически поддерживать влажность в камере до 90%.В связи с высоким уровнем влажности в инкубаторах высок риск роста бактерийи плесени, поэтому необходима регулярная очистка всех поверхностей камеры.Как правило, для этой цели используют 70% этиловый спирт, однако делать этонадо с большой осторожностью, поскольку известно негативное влияниеэтилового спирта на ооциты и ранние эмбрионы. ИДЕНТИФИКАЦИЯ И ОЦЕНКА КАЧЕСТВА ООЦИТОВ Во время трансвагинальной пункции (ТВП) преовуляторных фолликулов вместе сфолликулярной жидкостью в пробирки попадают комплексы ооцит-cumulus. Cumulusoophorus (яйценосный бугорок) представляет собой часть фолликулярногоэпителия, непосредственно контактирующую с ооцитом в процессефолликулогенеза. Помимо прочего фолликулярная жидкость содержит фибриноген,что приводит к образованию кровяных сгустков уже через несколько минут послеаспирации. Если ооцит находится в таком сгустке, его будет достаточно сложнообнаружить и впоследствии отмыть. Для преодоления этой проблемы используютсядва основных подхода:1. Фолликулярную жидкость просматривают под микроскопом сразу послеаспирации и найденные ооциты незамедлительно помещают в среду для отмывки.2. Фолликулярную жидкость собирают в пробирки, содержащие среду сгепарином, предотвращающую образование кровяных сгустков.Как правило, в большинстве лабораторий руководствуются вторым подходом. Приэтом используется гепарин в концентрации 50 МЕ/мл. Этот раствор в объеме 1 млдобавляется в пробирки объемом 8 - 10 мл, что дает конечную концентрациюгепарина в фолликулярной жидкости 5 - 8 МЕ/мл. Известно, что гепарин неоказывает влияния на оплодотворение и последующее развитие эмбриона.Комплексы ооцит-cumulus перед помещением в культуральную среду обязательноотмывают в специальной среде.После того как аспирированная фолликулярная жидкость попадает вэмбриологическую лабораторию, она незамедлительно просматривается наприсутствие комплексов ооцит-cumulus. Для этого содержимое пробирокпереливается в чашки Петри диаметром 9 см и исследуется под стереомикроскопомили инвертированным микроскопом при небольшом увеличении. Как правило,комплексы ооцит-cumulus видны и невооруженным глазом как блестящие слизистыекомки или тяжи диаметром 0,5 – 1 см.Найденные ооциты помещаются в среду для отмывки, содержащую HEPES-буфер,позволяющий манипулировать с ооцитами на воздухе без риска изменения рН вщелочную сторону (такие среды производятся большинством фирм,специализирующихся на производстве сред для ЭКО), затем отмываются вкультуральной среде и помещаются в лунку 4-луночной чашки либо в специальнуючашку для ЭКО, где в дальнейшем будет проводиться оплодотворение ооцитов икультивирование эмбрионов.Также допускается культивирование в небольших (5 – 10 мкл) каплях среды,покрытых слоем минерального масла, предварительно эквилиброванного скультуральной средой в присутствии 5% С02. Преимуществамикультивирования под маслом являются: препятствование попаданию в культуральнуюсреду микроорганизмов и частичек пыли, возможность культивирования внебольших каплях среды, что важно при оплодотворении спермой с небольшойконцентрацией активных сперматозоидов, а также замедление испарения воды ивыхода CO2 из среды вне инкубатора. Однако, если капли со средойпод маслом слишком долго находились вне инкубатора, возвращение к исходномуравновесию влажности и концентрации CO2 займет гораздо большевремени, чем в отсутствие масла.Манипуляции с ооцитами проводят с помощью оттянутых стерильных пастеровскихпипеток, имеющих небольшую резиновую грушу на конце, либо стеклянных(пластиковых) капилляров, присоединенных к микроаспиратору. Существуют идругие способы манипуляций с ооцитами и эмбрионами – выбор зависит отопыта и желания эмбриолога.Сразу после помещения ооцитов в культуральную среду необходимо оценитьколичество, качество и степень зрелости полученных комплексов ооцит-cumulus. Классификация комплексов ооцит-cumulus, применяемая в клинике Bourn Hall, Кембридж
, растворенные вбикарбонатном буфере (НCO3). Также добавлялись антибиотики дляпредотвращения бактериального заражения и источник белка в форме альбумина илисыворотки. Наиболее часто в качестве источника белка используется бычий иличеловеческий сывороточный альбумин, а также инактивированная человеческаясыворотка. Примерами таких сред могут служить Ml6, Т6, HTF (человеческаятрубная жидкость), EBSS (сбалансированный солевой раствор Эрла) и др. Болеесложные по составу среды, такие, как Ham's F10 и F12, aМЕМ, М199, хотя и былиразработаны для тканевых культур, но могут использоваться и для культивированияэмбрионов различных видов млекопитающих.Энергетическими субстратами для ооцитов и эмбрионов млекопитающих вкультуральной среде обычно служат пируват, лактат и глюкоза, причемусвоение глюкозы эмбрионы человека начинают лишь до прошествии несколькихклеточных делений, а до этого предпочтительным источником энергии служитпируват.Добавление аминокислот во многие культуральные среды объясняется ихприсутствием в жидкости яйцеводов многих видов млекопитающих. Было показано,что добавление глутамина в культуральную среду оказывает положительноевлияние на развитие эмбрионов многих видов млекопитающих. Однако привведении в среду аминокислот надо иметь в виду, что не все они остаютсястабильны в условиях культивирования – при температуре 37С многие из нихразрушаются, образуя аммоний, который при накоплении в среде обладаеттоксическим эффектом.Специально для культивирования эмбрионов Menezo с соавт. была разработанасреда В2, гораздо более сложная по составу: помимо солей, она содержитаминокислоты, витамины, нуклеотиды, микроэлементы и - в ряде случаев – дажежирные кислоты. Все эти среды применяются в практике ЭКО в различныхлабораториях. При том, что роль многих компонентов сложных сред до сих порне была убедительно показана, их применение дает хорошие результаты. CO2-ИНКУБАТОР Культивирование ооцитов и эмбрионов человека проводится в присутствии 5% CO3 в воздухе при температуре 37±0,1 °С и влажности 80 – 90%. Эти условиясоблюдаются при использовании CO3-инкубаторов, поддерживающихнеобходимую температуру, влажность и уровень CO2 в камере.Последний параметр поддерживается посредством подачи углекислого газа избаллона, где он находится в сжиженном состоянии, и воздуха из окружающей среды.Углекислый газ для культивирования должен соответствовать медицинскимстандартам по чистоте. В некоторых клиниках применяется готовая газовая смесь, содержащая углекислый газ, азот и кислород в нужной пропорции. Влажность в камере CO3-инкубаторов поддерживается постояннымиспарением воды со дна камеры либо из специального лотка. Также в некоторыхсовременных инкубаторах имеется система инжекции воды в циркулирующий воздух,позволяющая автоматически поддерживать влажность в камере до 90%.В связи с высоким уровнем влажности в инкубаторах высок риск роста бактерийи плесени, поэтому необходима регулярная очистка всех поверхностей камеры.Как правило, для этой цели используют 70% этиловый спирт, однако делать этонадо с большой осторожностью, поскольку известно негативное влияниеэтилового спирта на ооциты и ранние эмбрионы. ИДЕНТИФИКАЦИЯ И ОЦЕНКА КАЧЕСТВА ООЦИТОВ Во время трансвагинальной пункции (ТВП) преовуляторных фолликулов вместе сфолликулярной жидкостью в пробирки попадают комплексы ооцит-cumulus. Cumulusoophorus (яйценосный бугорок) представляет собой часть фолликулярногоэпителия, непосредственно контактирующую с ооцитом в процессефолликулогенеза. Помимо прочего фолликулярная жидкость содержит фибриноген,что приводит к образованию кровяных сгустков уже через несколько минут послеаспирации. Если ооцит находится в таком сгустке, его будет достаточно сложнообнаружить и впоследствии отмыть. Для преодоления этой проблемы используютсядва основных подхода:1. Фолликулярную жидкость просматривают под микроскопом сразу послеаспирации и найденные ооциты незамедлительно помещают в среду для отмывки.2. Фолликулярную жидкость собирают в пробирки, содержащие среду сгепарином, предотвращающую образование кровяных сгустков.Как правило, в большинстве лабораторий руководствуются вторым подходом. Приэтом используется гепарин в концентрации 50 МЕ/мл. Этот раствор в объеме 1 млдобавляется в пробирки объемом 8 - 10 мл, что дает конечную концентрациюгепарина в фолликулярной жидкости 5 - 8 МЕ/мл. Известно, что гепарин неоказывает влияния на оплодотворение и последующее развитие эмбриона.Комплексы ооцит-cumulus перед помещением в культуральную среду обязательноотмывают в специальной среде.После того как аспирированная фолликулярная жидкость попадает вэмбриологическую лабораторию, она незамедлительно просматривается наприсутствие комплексов ооцит-cumulus. Для этого содержимое пробирокпереливается в чашки Петри диаметром 9 см и исследуется под стереомикроскопомили инвертированным микроскопом при небольшом увеличении. Как правило,комплексы ооцит-cumulus видны и невооруженным глазом как блестящие слизистыекомки или тяжи диаметром 0,5 – 1 см.Найденные ооциты помещаются в среду для отмывки, содержащую HEPES-буфер,позволяющий манипулировать с ооцитами на воздухе без риска изменения рН вщелочную сторону (такие среды производятся большинством фирм,специализирующихся на производстве сред для ЭКО), затем отмываются вкультуральной среде и помещаются в лунку 4-луночной чашки либо в специальнуючашку для ЭКО, где в дальнейшем будет проводиться оплодотворение ооцитов икультивирование эмбрионов.Также допускается культивирование в небольших (5 – 10 мкл) каплях среды,покрытых слоем минерального масла, предварительно эквилиброванного скультуральной средой в присутствии 5% С02. Преимуществамикультивирования под маслом являются: препятствование попаданию в культуральнуюсреду микроорганизмов и частичек пыли, возможность культивирования внебольших каплях среды, что важно при оплодотворении спермой с небольшойконцентрацией активных сперматозоидов, а также замедление испарения воды ивыхода CO2 из среды вне инкубатора. Однако, если капли со средойпод маслом слишком долго находились вне инкубатора, возвращение к исходномуравновесию влажности и концентрации CO2 займет гораздо большевремени, чем в отсутствие масла.Манипуляции с ооцитами проводят с помощью оттянутых стерильных пастеровскихпипеток, имеющих небольшую резиновую грушу на конце, либо стеклянных(пластиковых) капилляров, присоединенных к микроаспиратору. Существуют идругие способы манипуляций с ооцитами и эмбрионами – выбор зависит отопыта и желания эмбриолога.Сразу после помещения ооцитов в культуральную среду необходимо оценитьколичество, качество и степень зрелости полученных комплексов ооцит-cumulus. Классификация комплексов ооцит-cumulus, применяемая в клинике Bourn Hall, Кембридж |
| Ооцит
| Характеристика
|
|
| Очень незрелый
| Клетки cumulus и corona radiata плотно упакованы вокруг ооцита. Иногда можно увидеть ядро ооцита - зародышевый пузырек. Такой ооцит находится на стадии профазы первого деления мейоза (GV-germinal vesicle stage), на которой происходит блок мейоза в процессе оогенеза. Полярное тельце еще не сформировалось
|
|
| Незрелый
| Клетки corona radiata все еще плотно примыкают к ооциту, cumulus незначительно увеличился. Такой ооцит обычно находится на стадии метафазы первого деления мейоза (М I), блок мейоза уже снят, однако формирование полярного тельца пока не произошло
|
|
| Преовуляторный
| Клетки corona radiala расходятся лучами от ооцита, cumulus разросшийся, но имеет клеточную структуру. Ооцит находится на стадии метафазы второго деления мейоза (М II), Полярное тельце уже сформировано
|
|
| Перезрелый
| Присутствует небольшое количество клеток corona radiata, уже не примыкающих плотно к ооциту, который хорошо просматривается. Cumulus разросшийся, но все еще имеет клеточную структуру. Полярное тельце обычно хорошо видно
|
|
| Лютеинизированный
| Вокруг ооцита клетки cumulus образуют скопления (комки), остальной cumulus представляет собой желеобразную массу с небольшим количеством клеток
|
|
| Дегенеративный
| Несколько клеток гранупезы окружают ооцит, cumulus отсутствует или очень маленький. Ооцит обычно темноокрашен
|
Оценка степени зрелости ооцитов по состоянию комплексов ооцит-cumulus, какправило, субъективна и часто не отвечает истинному состоянию ооцита.Асинхронность в созревании ядра ооцита, ооплазмы и клеток cumulus достаточночасто встречается в циклах стимуляции суперовуляции при ЭКО. Однако болееточное определение степени зрелости (если клетки corona radiata и cumulusудаляют ферментативно или механически) может привести к травматизации ооцитаи увеличению риска полиспермии при оплодотворении.На рис.2 представлены данные по распределению ооцитов, полученных в ходестимуляции суперовуляции, по степени зрелости. Оценка производилась послеудаления клеток cumulus. | Рис.2. Распределение ооцитов по степени зрелости ядра на момент ТВП: GV – стадия зародышевого пузырька (germinal vesic le) – очень незрелый ооцит; М I – стадия метафазы первого деления мейоза – незрелый ооцит; М II –стадия метафазы второго деления мейоза – зрелый ооцит; ATR –дегенеративный ооцит (См. рис. 3)
|
|
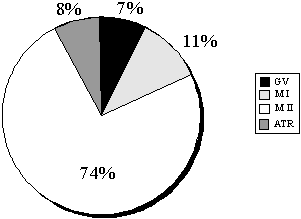
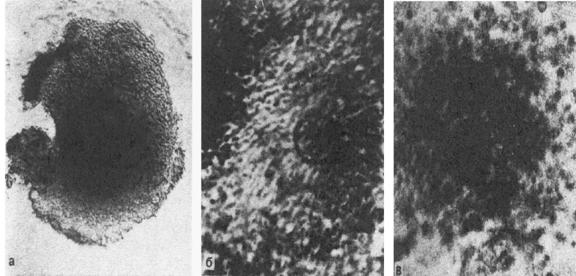 Рис.3. Ооцитарно-фолликулярные комплексы.а – незрелый; б – зрелый; в – перезревающий. Микрофотографии живых объектовв фазовом контрасте. ОБРАБОТКА СПЕРМЫ ПЕРЕД ОПЛОДОТВОРЕНИЕМ ООЦИТОВ in vitro Эякулят для ЭКО получают путем мастурбации в стерильный контейнер. Послеполного разжижения спермы, происходящего при комнатной температуре через 30 -60 мин, приступают к ее обработке. Предварительно необходимо провести анализконцентрации сперматозоидов, их подвижности и морфологических характеристикпо стандартной методике ВОЗ.Перед тем как добавлять сперму в культуральную среду с ооцитами, необходимоее обработать в целях удаления семенной плазмы и получения максимальнополноценной фракции прогрессивно подвижных сперматозоидов. На практикеприменяются два основных метода обработки спермы - центрифугирование-флотация (процедура swim-up) и градиентное центрифугирование.При использовании методики swim-up 1 – 2 мл спермы помещают в коническую 10 –15-миллиметровую пробирку, добавляют 5 - 10 мл среды для отмывки* и центрифугируют 5 – 10 мин при ускорении 1200 g. Затем супернатантудаляют, осадок ресуспендируют в 2 – 3 мл среды и вновь центрифугируют. Послеудаления супернатанта 1 – 2 мл свежей среды осторожно наслаивают на осадок,пробирку помещают в CO2-инкубатор при 37°С на 30 – 60 мин. В течениеэтого времени подвижные сперматозоиды должны мигрировать в наслоенную среду,оставив на дне пробирки неподвижные сперматозоиды, дебрис и иные клетки. Еслипробирки будут установлены наклонно, увеличится площадь контакта осадка сосредой и, соответственно, выход подвижных сперматозоидов. Для определенияконцентрации и подвижности сперматозоидов в надосадочной жидкости беретсяаликвота 10 или 50 мкл. Затем необходимое количество чистого супернатанта используется для инсеминации. Важным шагом вперед в методике обработки спермы стало внедрение методацентрифугирования в градиенте Перколла. Перколл представляет собой суспензиюсиликоновых гранул 15 – 30 нм в диаметре, покрытых слоем поливинилпирролидона(PVP), поскольку в чистом виде они токсичны для клеток. Особенностью Перколлаявляется очень низкая осмолярность – 25 мОсм/л, поэтому при разведении всреде до различных концентраций, соответствующих различным плотностям (от1,01 до 1,13 г/л), осмолярность растворов остается постоянной. РастворыПерколла (40 и 90%) готовятся из 100% раствора, представляющего собой смесь 9частей Перколла и 1 части 10-кратно концентрированной среды для отмывки.Прерывистый градиент плотности достигается путем помещения 1,5 мл 40%-гоПерколла на 1,5 мл 90%-го в конической пробирке; сверху аккуратнонаслаивается сперма (1 – 2 мл), и вся эта трехслойная колонкацентрифугируется 15 мин при ускорении 700 g. После центрифугирования в осадокпопадают только функционально нормальные сперматозоиды; неподвижные ианомальные сперматозоиды, а также лейкоциты и другие клетки спермызадерживаются на границе 40 и 90%-q фракций. Осадок отбирается пастеровскойпипеткой и два раза отмывается в специальной среде, как и в случаеприменения методики swim-up (см. выше).Последний метод, по мнению многих авторов, является более предпочтительным,сочетая в себе хорошую сепарацию и высокий выход фертильных сперматозоидов.Кроме того, описано и защитное действие Перколла: он не позволяет попасть восадок дефектным сперматозоидам, лейкоцитам и другим клеткам спермы,производящим большое количество свободных радикалов, способных повреждатьмембраны сперматозоидов. Таким образом, чем более благоприятно соотношениежизнеспособных сперматозоидов и дефектных, тем меньше вероятностьповреждений первых. ОПЛОДОТВОРЕНИЕ ООЦИТОВ in vitro Много споров и разночтений вызывает вопрос о времени введения сперматозоидовв среду, где культивируются ооциты. Наиболее общепринятым считается, чтомежду выделением первого полярного тельца ооцита (достижением стадии М II) идобавлением спермы должно пройти около 4 ч, тогда способность такого ооцита коплодотворению и последующему дроблению будет максимальной.Преовуляторный фолликул на момент аспирации (обычно 36 ч после введенияхорионического гонадотропина - ХГ, имитирующего пик эндогенного ЛГ в моментовуляции при естественном цикле), как правило, содержит ооцит на стадии МII. В естественных условиях овуляция, а значит, и возможность оплодотворениянаступает через 38 - 40 ч после пика ЛГ.На практике преинкубация ооцитов перед инсеминацией составляет от 2 до 6 ч.Данные по влиянию времени инкубации на оплодотворяемость ооцитов, дроблениеэмбрионов и беременность разноречивы. По данным К. Yanagida с соавт.,исследовавших такую зависимость при инкубации ооцитов в течение 1 - 11 чперед оплодотворением (применялся метод интрацитоплазматическоймикроинъекции сперматозоида в яйцеклетку - ИКСИ), способность ооцитов коплодотворению, последующему дроблению и имплантации статистическидостоверно снижается при инкубации их более 9 ч. Достоверных различий приинкубации в течение 1 - 9 ч не было обнаружено. В другом исследовании былопоказано, что инкубация более 9 ч перед оплодотворением наиболее оптимальнадля последующего прохождения всех вышеуказанных процессов при ИКСИ;исследователи предполагают, что это связано с дозреванием цитоплазмы ооцита,необходимым для его активации при оплодотворении.Важным моментом в обеих работах является то, что инкубация ооцитовпроисходила в присутствии клеток cumulus и corona radiata. Известно, чтосозревание ооцита полностью зависит от окружающих клеток фолликулярногоэпителия, поставляющих в ооплазму РНК и белки, необходимые для развитиябудущего организма до включения его собственного генома, а также белковыефакторы, отвечающие за процесс оплодотворения. Было показано, что дозреваниеооцитов in Ditro со стадии GV до стадии МII при интактном cumulusпроисходило с большей вероятностью, причем последующее их оплодотворение идробление было лучше.Несмотря на расхождение данных, большинство авторов считает, чтопреинкубация обязательно необходима, а ее оптимальная длительностьподбирается эмпирически в каждой лаборатории. При этом окно оплодотворениядля зрелого ооцита достаточно широко, однако преждевременное оплодотворениенедозревших ооцитов может негативно повлиять на исход дробления и имплантацииэмбрионов.Помимо фактора времени, в инсеминации важным является и количественныйфактор. Количество прогрессивно подвижных сперматозоидов обычно должносоставлять 50 - 100 тыс. на 1 мл среды (при культивировании в относительнобольшом объеме среды) либо на ооцит (при культивировании в микрокаплях подминеральным маслом). Подбирая концентрацию сперматозоидов приоплодотворении ооцитов in vitro, нужно иметь в виду, что при добавлениименее 50 тыс. активно подвижных сперматозоидов на 1 мл частота оплодотворениябудет существенно снижена, а при использовании очень высоких концентрацийвозникают побочные эффекты: полиспермия (проникновение более одногосперматозоида в ооцит при оплодотворении), снижение жизнеспособностиполученных эмбрионов (за счет повреждения кислородными радикалами, припопадании погибающих или мертвых сперматозоидов, либо воздействияизбыточного количества литических акросомальных ферментов).Однако это правило реализуется лишь в случае нормальной морфологиисперматозоидов, при наличии необходимой концентрации активно подвижныхсперматозоидов в эякуляте, отсутствии дефектов акросомальной реакции илиотсутствии больших концентраций антиспермальных антител в сперме (MAR-тестменее 50%). При наличии этих и других отрицательных факторов, а также принеудаче оплодотворения в предыдущей попытке ЭКО концентрация сперматозоидовможет быть повышена путем снижения объема среды культивирования(культивирование в микрокаплях, соломках для криоконсервации,микрокапиллярах), однако это далеко не всегда приводит к желаемымрезультатам. Для облегчения проникновения сперматозоида в ооцит клеткиcumulus и corona radiata могут быть удалены ферментативно и механически,однако это повышает риск полиспермии.
Рис.3. Ооцитарно-фолликулярные комплексы.а – незрелый; б – зрелый; в – перезревающий. Микрофотографии живых объектовв фазовом контрасте. ОБРАБОТКА СПЕРМЫ ПЕРЕД ОПЛОДОТВОРЕНИЕМ ООЦИТОВ in vitro Эякулят для ЭКО получают путем мастурбации в стерильный контейнер. Послеполного разжижения спермы, происходящего при комнатной температуре через 30 -60 мин, приступают к ее обработке. Предварительно необходимо провести анализконцентрации сперматозоидов, их подвижности и морфологических характеристикпо стандартной методике ВОЗ.Перед тем как добавлять сперму в культуральную среду с ооцитами, необходимоее обработать в целях удаления семенной плазмы и получения максимальнополноценной фракции прогрессивно подвижных сперматозоидов. На практикеприменяются два основных метода обработки спермы - центрифугирование-флотация (процедура swim-up) и градиентное центрифугирование.При использовании методики swim-up 1 – 2 мл спермы помещают в коническую 10 –15-миллиметровую пробирку, добавляют 5 - 10 мл среды для отмывки* и центрифугируют 5 – 10 мин при ускорении 1200 g. Затем супернатантудаляют, осадок ресуспендируют в 2 – 3 мл среды и вновь центрифугируют. Послеудаления супернатанта 1 – 2 мл свежей среды осторожно наслаивают на осадок,пробирку помещают в CO2-инкубатор при 37°С на 30 – 60 мин. В течениеэтого времени подвижные сперматозоиды должны мигрировать в наслоенную среду,оставив на дне пробирки неподвижные сперматозоиды, дебрис и иные клетки. Еслипробирки будут установлены наклонно, увеличится площадь контакта осадка сосредой и, соответственно, выход подвижных сперматозоидов. Для определенияконцентрации и подвижности сперматозоидов в надосадочной жидкости беретсяаликвота 10 или 50 мкл. Затем необходимое количество чистого супернатанта используется для инсеминации. Важным шагом вперед в методике обработки спермы стало внедрение методацентрифугирования в градиенте Перколла. Перколл представляет собой суспензиюсиликоновых гранул 15 – 30 нм в диаметре, покрытых слоем поливинилпирролидона(PVP), поскольку в чистом виде они токсичны для клеток. Особенностью Перколлаявляется очень низкая осмолярность – 25 мОсм/л, поэтому при разведении всреде до различных концентраций, соответствующих различным плотностям (от1,01 до 1,13 г/л), осмолярность растворов остается постоянной. РастворыПерколла (40 и 90%) готовятся из 100% раствора, представляющего собой смесь 9частей Перколла и 1 части 10-кратно концентрированной среды для отмывки.Прерывистый градиент плотности достигается путем помещения 1,5 мл 40%-гоПерколла на 1,5 мл 90%-го в конической пробирке; сверху аккуратнонаслаивается сперма (1 – 2 мл), и вся эта трехслойная колонкацентрифугируется 15 мин при ускорении 700 g. После центрифугирования в осадокпопадают только функционально нормальные сперматозоиды; неподвижные ианомальные сперматозоиды, а также лейкоциты и другие клетки спермызадерживаются на границе 40 и 90%-q фракций. Осадок отбирается пастеровскойпипеткой и два раза отмывается в специальной среде, как и в случаеприменения методики swim-up (см. выше).Последний метод, по мнению многих авторов, является более предпочтительным,сочетая в себе хорошую сепарацию и высокий выход фертильных сперматозоидов.Кроме того, описано и защитное действие Перколла: он не позволяет попасть восадок дефектным сперматозоидам, лейкоцитам и другим клеткам спермы,производящим большое количество свободных радикалов, способных повреждатьмембраны сперматозоидов. Таким образом, чем более благоприятно соотношениежизнеспособных сперматозоидов и дефектных, тем меньше вероятностьповреждений первых. ОПЛОДОТВОРЕНИЕ ООЦИТОВ in vitro Много споров и разночтений вызывает вопрос о времени введения сперматозоидовв среду, где культивируются ооциты. Наиболее общепринятым считается, чтомежду выделением первого полярного тельца ооцита (достижением стадии М II) идобавлением спермы должно пройти около 4 ч, тогда способность такого ооцита коплодотворению и последующему дроблению будет максимальной.Преовуляторный фолликул на момент аспирации (обычно 36 ч после введенияхорионического гонадотропина - ХГ, имитирующего пик эндогенного ЛГ в моментовуляции при естественном цикле), как правило, содержит ооцит на стадии МII. В естественных условиях овуляция, а значит, и возможность оплодотворениянаступает через 38 - 40 ч после пика ЛГ.На практике преинкубация ооцитов перед инсеминацией составляет от 2 до 6 ч.Данные по влиянию времени инкубации на оплодотворяемость ооцитов, дроблениеэмбрионов и беременность разноречивы. По данным К. Yanagida с соавт.,исследовавших такую зависимость при инкубации ооцитов в течение 1 - 11 чперед оплодотворением (применялся метод интрацитоплазматическоймикроинъекции сперматозоида в яйцеклетку - ИКСИ), способность ооцитов коплодотворению, последующему дроблению и имплантации статистическидостоверно снижается при инкубации их более 9 ч. Достоверных различий приинкубации в течение 1 - 9 ч не было обнаружено. В другом исследовании былопоказано, что инкубация более 9 ч перед оплодотворением наиболее оптимальнадля последующего прохождения всех вышеуказанных процессов при ИКСИ;исследователи предполагают, что это связано с дозреванием цитоплазмы ооцита,необходимым для его активации при оплодотворении.Важным моментом в обеих работах является то, что инкубация ооцитовпроисходила в присутствии клеток cumulus и corona radiata. Известно, чтосозревание ооцита полностью зависит от окружающих клеток фолликулярногоэпителия, поставляющих в ооплазму РНК и белки, необходимые для развитиябудущего организма до включения его собственного генома, а также белковыефакторы, отвечающие за процесс оплодотворения. Было показано, что дозреваниеооцитов in Ditro со стадии GV до стадии МII при интактном cumulusпроисходило с большей вероятностью, причем последующее их оплодотворение идробление было лучше.Несмотря на расхождение данных, большинство авторов считает, чтопреинкубация обязательно необходима, а ее оптимальная длительностьподбирается эмпирически в каждой лаборатории. При этом окно оплодотворениядля зрелого ооцита достаточно широко, однако преждевременное оплодотворениенедозревших ооцитов может негативно повлиять на исход дробления и имплантацииэмбрионов.Помимо фактора времени, в инсеминации важным является и количественныйфактор. Количество прогрессивно подвижных сперматозоидов обычно должносоставлять 50 - 100 тыс. на 1 мл среды (при культивировании в относительнобольшом объеме среды) либо на ооцит (при культивировании в микрокаплях подминеральным маслом). Подбирая концентрацию сперматозоидов приоплодотворении ооцитов in vitro, нужно иметь в виду, что при добавлениименее 50 тыс. активно подвижных сперматозоидов на 1 мл частота оплодотворениябудет существенно снижена, а при использовании очень высоких концентрацийвозникают побочные эффекты: полиспермия (проникновение более одногосперматозоида в ооцит при оплодотворении), снижение жизнеспособностиполученных эмбрионов (за счет повреждения кислородными радикалами, припопадании погибающих или мертвых сперматозоидов, либо воздействияизбыточного количества литических акросомальных ферментов).Однако это правило реализуется лишь в случае нормальной морфологиисперматозоидов, при наличии необходимой концентрации активно подвижныхсперматозоидов в эякуляте, отсутствии дефектов акросомальной реакции илиотсутствии больших концентраций антиспермальных антител в сперме (MAR-тестменее 50%). При наличии этих и других отрицательных факторов, а также принеудаче оплодотворения в предыдущей попытке ЭКО концентрация сперматозоидовможет быть повышена путем снижения объема среды культивирования(культивирование в микрокаплях, соломках для криоконсервации,микрокапиллярах), однако это далеко не всегда приводит к желаемымрезультатам. Для облегчения проникновения сперматозоида в ооцит клеткиcumulus и corona radiata могут быть удалены ферментативно и механически,однако это повышает риск полиспермии.
Дата добавления: 2015-08-08; просмотров: 772;
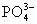 и
и 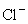 , растворенные вбикарбонатном буфере (НCO3). Также добавлялись антибиотики дляпредотвращения бактериального заражения и источник белка в форме альбумина илисыворотки. Наиболее часто в качестве источника белка используется бычий иличеловеческий сывороточный альбумин, а также инактивированная человеческаясыворотка. Примерами таких сред могут служить Ml6, Т6, HTF (человеческаятрубная жидкость), EBSS (сбалансированный солевой раствор Эрла) и др. Болеесложные по составу среды, такие, как Ham's F10 и F12, aМЕМ, М199, хотя и былиразработаны для тканевых культур, но могут использоваться и для культивированияэмбрионов различных видов млекопитающих.Энергетическими субстратами для ооцитов и эмбрионов млекопитающих вкультуральной среде обычно служат пируват, лактат и глюкоза, причемусвоение глюкозы эмбрионы человека начинают лишь до прошествии несколькихклеточных делений, а до этого предпочтительным источником энергии служитпируват.Добавление аминокислот во многие культуральные среды объясняется ихприсутствием в жидкости яйцеводов многих видов млекопитающих. Было показано,что добавление глутамина в культуральную среду оказывает положительноевлияние на развитие эмбрионов многих видов млекопитающих. Однако привведении в среду аминокислот надо иметь в виду, что не все они остаютсястабильны в условиях культивирования – при температуре 37С многие из нихразрушаются, образуя аммоний, который при накоплении в среде обладаеттоксическим эффектом.Специально для культивирования эмбрионов Menezo с соавт. была разработанасреда В2, гораздо более сложная по составу: помимо солей, она содержитаминокислоты, витамины, нуклеотиды, микроэлементы и - в ряде случаев – дажежирные кислоты. Все эти среды применяются в практике ЭКО в различныхлабораториях. При том, что роль многих компонентов сложных сред до сих порне была убедительно показана, их применение дает хорошие результаты. CO2-ИНКУБАТОР Культивирование ооцитов и эмбрионов человека проводится в присутствии 5% CO3 в воздухе при температуре 37±0,1 °С и влажности 80 – 90%. Эти условиясоблюдаются при использовании CO3-инкубаторов, поддерживающихнеобходимую температуру, влажность и уровень CO2 в камере.Последний параметр поддерживается посредством подачи углекислого газа избаллона, где он находится в сжиженном состоянии, и воздуха из окружающей среды.Углекислый газ для культивирования должен соответствовать медицинскимстандартам по чистоте. В некоторых клиниках применяется готовая газовая смесь, содержащая углекислый газ, азот и кислород в нужной пропорции. Влажность в камере CO3-инкубаторов поддерживается постояннымиспарением воды со дна камеры либо из специального лотка. Также в некоторыхсовременных инкубаторах имеется система инжекции воды в циркулирующий воздух,позволяющая автоматически поддерживать влажность в камере до 90%.В связи с высоким уровнем влажности в инкубаторах высок риск роста бактерийи плесени, поэтому необходима регулярная очистка всех поверхностей камеры.Как правило, для этой цели используют 70% этиловый спирт, однако делать этонадо с большой осторожностью, поскольку известно негативное влияниеэтилового спирта на ооциты и ранние эмбрионы. ИДЕНТИФИКАЦИЯ И ОЦЕНКА КАЧЕСТВА ООЦИТОВ Во время трансвагинальной пункции (ТВП) преовуляторных фолликулов вместе сфолликулярной жидкостью в пробирки попадают комплексы ооцит-cumulus. Cumulusoophorus (яйценосный бугорок) представляет собой часть фолликулярногоэпителия, непосредственно контактирующую с ооцитом в процессефолликулогенеза. Помимо прочего фолликулярная жидкость содержит фибриноген,что приводит к образованию кровяных сгустков уже через несколько минут послеаспирации. Если ооцит находится в таком сгустке, его будет достаточно сложнообнаружить и впоследствии отмыть. Для преодоления этой проблемы используютсядва основных подхода:1. Фолликулярную жидкость просматривают под микроскопом сразу послеаспирации и найденные ооциты незамедлительно помещают в среду для отмывки.2. Фолликулярную жидкость собирают в пробирки, содержащие среду сгепарином, предотвращающую образование кровяных сгустков.Как правило, в большинстве лабораторий руководствуются вторым подходом. Приэтом используется гепарин в концентрации 50 МЕ/мл. Этот раствор в объеме 1 млдобавляется в пробирки объемом 8 - 10 мл, что дает конечную концентрациюгепарина в фолликулярной жидкости 5 - 8 МЕ/мл. Известно, что гепарин неоказывает влияния на оплодотворение и последующее развитие эмбриона.Комплексы ооцит-cumulus перед помещением в культуральную среду обязательноотмывают в специальной среде.После того как аспирированная фолликулярная жидкость попадает вэмбриологическую лабораторию, она незамедлительно просматривается наприсутствие комплексов ооцит-cumulus. Для этого содержимое пробирокпереливается в чашки Петри диаметром 9 см и исследуется под стереомикроскопомили инвертированным микроскопом при небольшом увеличении. Как правило,комплексы ооцит-cumulus видны и невооруженным глазом как блестящие слизистыекомки или тяжи диаметром 0,5 – 1 см.Найденные ооциты помещаются в среду для отмывки, содержащую HEPES-буфер,позволяющий манипулировать с ооцитами на воздухе без риска изменения рН вщелочную сторону (такие среды производятся большинством фирм,специализирующихся на производстве сред для ЭКО), затем отмываются вкультуральной среде и помещаются в лунку 4-луночной чашки либо в специальнуючашку для ЭКО, где в дальнейшем будет проводиться оплодотворение ооцитов икультивирование эмбрионов.Также допускается культивирование в небольших (5 – 10 мкл) каплях среды,покрытых слоем минерального масла, предварительно эквилиброванного скультуральной средой в присутствии 5% С02. Преимуществамикультивирования под маслом являются: препятствование попаданию в культуральнуюсреду микроорганизмов и частичек пыли, возможность культивирования внебольших каплях среды, что важно при оплодотворении спермой с небольшойконцентрацией активных сперматозоидов, а также замедление испарения воды ивыхода CO2 из среды вне инкубатора. Однако, если капли со средойпод маслом слишком долго находились вне инкубатора, возвращение к исходномуравновесию влажности и концентрации CO2 займет гораздо большевремени, чем в отсутствие масла.Манипуляции с ооцитами проводят с помощью оттянутых стерильных пастеровскихпипеток, имеющих небольшую резиновую грушу на конце, либо стеклянных(пластиковых) капилляров, присоединенных к микроаспиратору. Существуют идругие способы манипуляций с ооцитами и эмбрионами – выбор зависит отопыта и желания эмбриолога.Сразу после помещения ооцитов в культуральную среду необходимо оценитьколичество, качество и степень зрелости полученных комплексов ооцит-cumulus. Классификация комплексов ооцит-cumulus, применяемая в клинике Bourn Hall, Кембридж
, растворенные вбикарбонатном буфере (НCO3). Также добавлялись антибиотики дляпредотвращения бактериального заражения и источник белка в форме альбумина илисыворотки. Наиболее часто в качестве источника белка используется бычий иличеловеческий сывороточный альбумин, а также инактивированная человеческаясыворотка. Примерами таких сред могут служить Ml6, Т6, HTF (человеческаятрубная жидкость), EBSS (сбалансированный солевой раствор Эрла) и др. Болеесложные по составу среды, такие, как Ham's F10 и F12, aМЕМ, М199, хотя и былиразработаны для тканевых культур, но могут использоваться и для культивированияэмбрионов различных видов млекопитающих.Энергетическими субстратами для ооцитов и эмбрионов млекопитающих вкультуральной среде обычно служат пируват, лактат и глюкоза, причемусвоение глюкозы эмбрионы человека начинают лишь до прошествии несколькихклеточных делений, а до этого предпочтительным источником энергии служитпируват.Добавление аминокислот во многие культуральные среды объясняется ихприсутствием в жидкости яйцеводов многих видов млекопитающих. Было показано,что добавление глутамина в культуральную среду оказывает положительноевлияние на развитие эмбрионов многих видов млекопитающих. Однако привведении в среду аминокислот надо иметь в виду, что не все они остаютсястабильны в условиях культивирования – при температуре 37С многие из нихразрушаются, образуя аммоний, который при накоплении в среде обладаеттоксическим эффектом.Специально для культивирования эмбрионов Menezo с соавт. была разработанасреда В2, гораздо более сложная по составу: помимо солей, она содержитаминокислоты, витамины, нуклеотиды, микроэлементы и - в ряде случаев – дажежирные кислоты. Все эти среды применяются в практике ЭКО в различныхлабораториях. При том, что роль многих компонентов сложных сред до сих порне была убедительно показана, их применение дает хорошие результаты. CO2-ИНКУБАТОР Культивирование ооцитов и эмбрионов человека проводится в присутствии 5% CO3 в воздухе при температуре 37±0,1 °С и влажности 80 – 90%. Эти условиясоблюдаются при использовании CO3-инкубаторов, поддерживающихнеобходимую температуру, влажность и уровень CO2 в камере.Последний параметр поддерживается посредством подачи углекислого газа избаллона, где он находится в сжиженном состоянии, и воздуха из окружающей среды.Углекислый газ для культивирования должен соответствовать медицинскимстандартам по чистоте. В некоторых клиниках применяется готовая газовая смесь, содержащая углекислый газ, азот и кислород в нужной пропорции. Влажность в камере CO3-инкубаторов поддерживается постояннымиспарением воды со дна камеры либо из специального лотка. Также в некоторыхсовременных инкубаторах имеется система инжекции воды в циркулирующий воздух,позволяющая автоматически поддерживать влажность в камере до 90%.В связи с высоким уровнем влажности в инкубаторах высок риск роста бактерийи плесени, поэтому необходима регулярная очистка всех поверхностей камеры.Как правило, для этой цели используют 70% этиловый спирт, однако делать этонадо с большой осторожностью, поскольку известно негативное влияниеэтилового спирта на ооциты и ранние эмбрионы. ИДЕНТИФИКАЦИЯ И ОЦЕНКА КАЧЕСТВА ООЦИТОВ Во время трансвагинальной пункции (ТВП) преовуляторных фолликулов вместе сфолликулярной жидкостью в пробирки попадают комплексы ооцит-cumulus. Cumulusoophorus (яйценосный бугорок) представляет собой часть фолликулярногоэпителия, непосредственно контактирующую с ооцитом в процессефолликулогенеза. Помимо прочего фолликулярная жидкость содержит фибриноген,что приводит к образованию кровяных сгустков уже через несколько минут послеаспирации. Если ооцит находится в таком сгустке, его будет достаточно сложнообнаружить и впоследствии отмыть. Для преодоления этой проблемы используютсядва основных подхода:1. Фолликулярную жидкость просматривают под микроскопом сразу послеаспирации и найденные ооциты незамедлительно помещают в среду для отмывки.2. Фолликулярную жидкость собирают в пробирки, содержащие среду сгепарином, предотвращающую образование кровяных сгустков.Как правило, в большинстве лабораторий руководствуются вторым подходом. Приэтом используется гепарин в концентрации 50 МЕ/мл. Этот раствор в объеме 1 млдобавляется в пробирки объемом 8 - 10 мл, что дает конечную концентрациюгепарина в фолликулярной жидкости 5 - 8 МЕ/мл. Известно, что гепарин неоказывает влияния на оплодотворение и последующее развитие эмбриона.Комплексы ооцит-cumulus перед помещением в культуральную среду обязательноотмывают в специальной среде.После того как аспирированная фолликулярная жидкость попадает вэмбриологическую лабораторию, она незамедлительно просматривается наприсутствие комплексов ооцит-cumulus. Для этого содержимое пробирокпереливается в чашки Петри диаметром 9 см и исследуется под стереомикроскопомили инвертированным микроскопом при небольшом увеличении. Как правило,комплексы ооцит-cumulus видны и невооруженным глазом как блестящие слизистыекомки или тяжи диаметром 0,5 – 1 см.Найденные ооциты помещаются в среду для отмывки, содержащую HEPES-буфер,позволяющий манипулировать с ооцитами на воздухе без риска изменения рН вщелочную сторону (такие среды производятся большинством фирм,специализирующихся на производстве сред для ЭКО), затем отмываются вкультуральной среде и помещаются в лунку 4-луночной чашки либо в специальнуючашку для ЭКО, где в дальнейшем будет проводиться оплодотворение ооцитов икультивирование эмбрионов.Также допускается культивирование в небольших (5 – 10 мкл) каплях среды,покрытых слоем минерального масла, предварительно эквилиброванного скультуральной средой в присутствии 5% С02. Преимуществамикультивирования под маслом являются: препятствование попаданию в культуральнуюсреду микроорганизмов и частичек пыли, возможность культивирования внебольших каплях среды, что важно при оплодотворении спермой с небольшойконцентрацией активных сперматозоидов, а также замедление испарения воды ивыхода CO2 из среды вне инкубатора. Однако, если капли со средойпод маслом слишком долго находились вне инкубатора, возвращение к исходномуравновесию влажности и концентрации CO2 займет гораздо большевремени, чем в отсутствие масла.Манипуляции с ооцитами проводят с помощью оттянутых стерильных пастеровскихпипеток, имеющих небольшую резиновую грушу на конце, либо стеклянных(пластиковых) капилляров, присоединенных к микроаспиратору. Существуют идругие способы манипуляций с ооцитами и эмбрионами – выбор зависит отопыта и желания эмбриолога.Сразу после помещения ооцитов в культуральную среду необходимо оценитьколичество, качество и степень зрелости полученных комплексов ооцит-cumulus. Классификация комплексов ооцит-cumulus, применяемая в клинике Bourn Hall, Кембридж 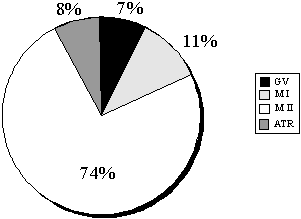
 Рис.3. Ооцитарно-фолликулярные комплексы.а – незрелый; б – зрелый; в – перезревающий. Микрофотографии живых объектовв фазовом контрасте. ОБРАБОТКА СПЕРМЫ ПЕРЕД ОПЛОДОТВОРЕНИЕМ ООЦИТОВ in vitro Эякулят для ЭКО получают путем мастурбации в стерильный контейнер. Послеполного разжижения спермы, происходящего при комнатной температуре через 30 -60 мин, приступают к ее обработке. Предварительно необходимо провести анализконцентрации сперматозоидов, их подвижности и морфологических характеристикпо стандартной методике ВОЗ.Перед тем как добавлять сперму в культуральную среду с ооцитами, необходимоее обработать в целях удаления семенной плазмы и получения максимальнополноценной фракции прогрессивно подвижных сперматозоидов. На практикеприменяются два основных метода обработки спермы - центрифугирование-флотация (процедура swim-up) и градиентное центрифугирование.При использовании методики swim-up 1 – 2 мл спермы помещают в коническую 10 –15-миллиметровую пробирку, добавляют 5 - 10 мл среды для отмывки* и центрифугируют 5 – 10 мин при ускорении 1200 g. Затем супернатантудаляют, осадок ресуспендируют в 2 – 3 мл среды и вновь центрифугируют. Послеудаления супернатанта 1 – 2 мл свежей среды осторожно наслаивают на осадок,пробирку помещают в CO2-инкубатор при 37°С на 30 – 60 мин. В течениеэтого времени подвижные сперматозоиды должны мигрировать в наслоенную среду,оставив на дне пробирки неподвижные сперматозоиды, дебрис и иные клетки. Еслипробирки будут установлены наклонно, увеличится площадь контакта осадка сосредой и, соответственно, выход подвижных сперматозоидов. Для определенияконцентрации и подвижности сперматозоидов в надосадочной жидкости беретсяаликвота 10 или 50 мкл. Затем необходимое количество чистого супернатанта используется для инсеминации. Важным шагом вперед в методике обработки спермы стало внедрение методацентрифугирования в градиенте Перколла. Перколл представляет собой суспензиюсиликоновых гранул 15 – 30 нм в диаметре, покрытых слоем поливинилпирролидона(PVP), поскольку в чистом виде они токсичны для клеток. Особенностью Перколлаявляется очень низкая осмолярность – 25 мОсм/л, поэтому при разведении всреде до различных концентраций, соответствующих различным плотностям (от1,01 до 1,13 г/л), осмолярность растворов остается постоянной. РастворыПерколла (40 и 90%) готовятся из 100% раствора, представляющего собой смесь 9частей Перколла и 1 части 10-кратно концентрированной среды для отмывки.Прерывистый градиент плотности достигается путем помещения 1,5 мл 40%-гоПерколла на 1,5 мл 90%-го в конической пробирке; сверху аккуратнонаслаивается сперма (1 – 2 мл), и вся эта трехслойная колонкацентрифугируется 15 мин при ускорении 700 g. После центрифугирования в осадокпопадают только функционально нормальные сперматозоиды; неподвижные ианомальные сперматозоиды, а также лейкоциты и другие клетки спермызадерживаются на границе 40 и 90%-q фракций. Осадок отбирается пастеровскойпипеткой и два раза отмывается в специальной среде, как и в случаеприменения методики swim-up (см. выше).Последний метод, по мнению многих авторов, является более предпочтительным,сочетая в себе хорошую сепарацию и высокий выход фертильных сперматозоидов.Кроме того, описано и защитное действие Перколла: он не позволяет попасть восадок дефектным сперматозоидам, лейкоцитам и другим клеткам спермы,производящим большое количество свободных радикалов, способных повреждатьмембраны сперматозоидов. Таким образом, чем более благоприятно соотношениежизнеспособных сперматозоидов и дефектных, тем меньше вероятностьповреждений первых. ОПЛОДОТВОРЕНИЕ ООЦИТОВ in vitro Много споров и разночтений вызывает вопрос о времени введения сперматозоидовв среду, где культивируются ооциты. Наиболее общепринятым считается, чтомежду выделением первого полярного тельца ооцита (достижением стадии М II) идобавлением спермы должно пройти около 4 ч, тогда способность такого ооцита коплодотворению и последующему дроблению будет максимальной.Преовуляторный фолликул на момент аспирации (обычно 36 ч после введенияхорионического гонадотропина - ХГ, имитирующего пик эндогенного ЛГ в моментовуляции при естественном цикле), как правило, содержит ооцит на стадии МII. В естественных условиях овуляция, а значит, и возможность оплодотворениянаступает через 38 - 40 ч после пика ЛГ.На практике преинкубация ооцитов перед инсеминацией составляет от 2 до 6 ч.Данные по влиянию времени инкубации на оплодотворяемость ооцитов, дроблениеэмбрионов и беременность разноречивы. По данным К. Yanagida с соавт.,исследовавших такую зависимость при инкубации ооцитов в течение 1 - 11 чперед оплодотворением (применялся метод интрацитоплазматическоймикроинъекции сперматозоида в яйцеклетку - ИКСИ), способность ооцитов коплодотворению, последующему дроблению и имплантации статистическидостоверно снижается при инкубации их более 9 ч. Достоверных различий приинкубации в течение 1 - 9 ч не было обнаружено. В другом исследовании былопоказано, что инкубация более 9 ч перед оплодотворением наиболее оптимальнадля последующего прохождения всех вышеуказанных процессов при ИКСИ;исследователи предполагают, что это связано с дозреванием цитоплазмы ооцита,необходимым для его активации при оплодотворении.Важным моментом в обеих работах является то, что инкубация ооцитовпроисходила в присутствии клеток cumulus и corona radiata. Известно, чтосозревание ооцита полностью зависит от окружающих клеток фолликулярногоэпителия, поставляющих в ооплазму РНК и белки, необходимые для развитиябудущего организма до включения его собственного генома, а также белковыефакторы, отвечающие за процесс оплодотворения. Было показано, что дозреваниеооцитов in Ditro со стадии GV до стадии МII при интактном cumulusпроисходило с большей вероятностью, причем последующее их оплодотворение идробление было лучше.Несмотря на расхождение данных, большинство авторов считает, чтопреинкубация обязательно необходима, а ее оптимальная длительностьподбирается эмпирически в каждой лаборатории. При этом окно оплодотворениядля зрелого ооцита достаточно широко, однако преждевременное оплодотворениенедозревших ооцитов может негативно повлиять на исход дробления и имплантацииэмбрионов.Помимо фактора времени, в инсеминации важным является и количественныйфактор. Количество прогрессивно подвижных сперматозоидов обычно должносоставлять 50 - 100 тыс. на 1 мл среды (при культивировании в относительнобольшом объеме среды) либо на ооцит (при культивировании в микрокаплях подминеральным маслом). Подбирая концентрацию сперматозоидов приоплодотворении ооцитов in vitro, нужно иметь в виду, что при добавлениименее 50 тыс. активно подвижных сперматозоидов на 1 мл частота оплодотворениябудет существенно снижена, а при использовании очень высоких концентрацийвозникают побочные эффекты: полиспермия (проникновение более одногосперматозоида в ооцит при оплодотворении), снижение жизнеспособностиполученных эмбрионов (за счет повреждения кислородными радикалами, припопадании погибающих или мертвых сперматозоидов, либо воздействияизбыточного количества литических акросомальных ферментов).Однако это правило реализуется лишь в случае нормальной морфологиисперматозоидов, при наличии необходимой концентрации активно подвижныхсперматозоидов в эякуляте, отсутствии дефектов акросомальной реакции илиотсутствии больших концентраций антиспермальных антител в сперме (MAR-тестменее 50%). При наличии этих и других отрицательных факторов, а также принеудаче оплодотворения в предыдущей попытке ЭКО концентрация сперматозоидовможет быть повышена путем снижения объема среды культивирования(культивирование в микрокаплях, соломках для криоконсервации,микрокапиллярах), однако это далеко не всегда приводит к желаемымрезультатам. Для облегчения проникновения сперматозоида в ооцит клеткиcumulus и corona radiata могут быть удалены ферментативно и механически,однако это повышает риск полиспермии.
Рис.3. Ооцитарно-фолликулярные комплексы.а – незрелый; б – зрелый; в – перезревающий. Микрофотографии живых объектовв фазовом контрасте. ОБРАБОТКА СПЕРМЫ ПЕРЕД ОПЛОДОТВОРЕНИЕМ ООЦИТОВ in vitro Эякулят для ЭКО получают путем мастурбации в стерильный контейнер. Послеполного разжижения спермы, происходящего при комнатной температуре через 30 -60 мин, приступают к ее обработке. Предварительно необходимо провести анализконцентрации сперматозоидов, их подвижности и морфологических характеристикпо стандартной методике ВОЗ.Перед тем как добавлять сперму в культуральную среду с ооцитами, необходимоее обработать в целях удаления семенной плазмы и получения максимальнополноценной фракции прогрессивно подвижных сперматозоидов. На практикеприменяются два основных метода обработки спермы - центрифугирование-флотация (процедура swim-up) и градиентное центрифугирование.При использовании методики swim-up 1 – 2 мл спермы помещают в коническую 10 –15-миллиметровую пробирку, добавляют 5 - 10 мл среды для отмывки* и центрифугируют 5 – 10 мин при ускорении 1200 g. Затем супернатантудаляют, осадок ресуспендируют в 2 – 3 мл среды и вновь центрифугируют. Послеудаления супернатанта 1 – 2 мл свежей среды осторожно наслаивают на осадок,пробирку помещают в CO2-инкубатор при 37°С на 30 – 60 мин. В течениеэтого времени подвижные сперматозоиды должны мигрировать в наслоенную среду,оставив на дне пробирки неподвижные сперматозоиды, дебрис и иные клетки. Еслипробирки будут установлены наклонно, увеличится площадь контакта осадка сосредой и, соответственно, выход подвижных сперматозоидов. Для определенияконцентрации и подвижности сперматозоидов в надосадочной жидкости беретсяаликвота 10 или 50 мкл. Затем необходимое количество чистого супернатанта используется для инсеминации. Важным шагом вперед в методике обработки спермы стало внедрение методацентрифугирования в градиенте Перколла. Перколл представляет собой суспензиюсиликоновых гранул 15 – 30 нм в диаметре, покрытых слоем поливинилпирролидона(PVP), поскольку в чистом виде они токсичны для клеток. Особенностью Перколлаявляется очень низкая осмолярность – 25 мОсм/л, поэтому при разведении всреде до различных концентраций, соответствующих различным плотностям (от1,01 до 1,13 г/л), осмолярность растворов остается постоянной. РастворыПерколла (40 и 90%) готовятся из 100% раствора, представляющего собой смесь 9частей Перколла и 1 части 10-кратно концентрированной среды для отмывки.Прерывистый градиент плотности достигается путем помещения 1,5 мл 40%-гоПерколла на 1,5 мл 90%-го в конической пробирке; сверху аккуратнонаслаивается сперма (1 – 2 мл), и вся эта трехслойная колонкацентрифугируется 15 мин при ускорении 700 g. После центрифугирования в осадокпопадают только функционально нормальные сперматозоиды; неподвижные ианомальные сперматозоиды, а также лейкоциты и другие клетки спермызадерживаются на границе 40 и 90%-q фракций. Осадок отбирается пастеровскойпипеткой и два раза отмывается в специальной среде, как и в случаеприменения методики swim-up (см. выше).Последний метод, по мнению многих авторов, является более предпочтительным,сочетая в себе хорошую сепарацию и высокий выход фертильных сперматозоидов.Кроме того, описано и защитное действие Перколла: он не позволяет попасть восадок дефектным сперматозоидам, лейкоцитам и другим клеткам спермы,производящим большое количество свободных радикалов, способных повреждатьмембраны сперматозоидов. Таким образом, чем более благоприятно соотношениежизнеспособных сперматозоидов и дефектных, тем меньше вероятностьповреждений первых. ОПЛОДОТВОРЕНИЕ ООЦИТОВ in vitro Много споров и разночтений вызывает вопрос о времени введения сперматозоидовв среду, где культивируются ооциты. Наиболее общепринятым считается, чтомежду выделением первого полярного тельца ооцита (достижением стадии М II) идобавлением спермы должно пройти около 4 ч, тогда способность такого ооцита коплодотворению и последующему дроблению будет максимальной.Преовуляторный фолликул на момент аспирации (обычно 36 ч после введенияхорионического гонадотропина - ХГ, имитирующего пик эндогенного ЛГ в моментовуляции при естественном цикле), как правило, содержит ооцит на стадии МII. В естественных условиях овуляция, а значит, и возможность оплодотворениянаступает через 38 - 40 ч после пика ЛГ.На практике преинкубация ооцитов перед инсеминацией составляет от 2 до 6 ч.Данные по влиянию времени инкубации на оплодотворяемость ооцитов, дроблениеэмбрионов и беременность разноречивы. По данным К. Yanagida с соавт.,исследовавших такую зависимость при инкубации ооцитов в течение 1 - 11 чперед оплодотворением (применялся метод интрацитоплазматическоймикроинъекции сперматозоида в яйцеклетку - ИКСИ), способность ооцитов коплодотворению, последующему дроблению и имплантации статистическидостоверно снижается при инкубации их более 9 ч. Достоверных различий приинкубации в течение 1 - 9 ч не было обнаружено. В другом исследовании былопоказано, что инкубация более 9 ч перед оплодотворением наиболее оптимальнадля последующего прохождения всех вышеуказанных процессов при ИКСИ;исследователи предполагают, что это связано с дозреванием цитоплазмы ооцита,необходимым для его активации при оплодотворении.Важным моментом в обеих работах является то, что инкубация ооцитовпроисходила в присутствии клеток cumulus и corona radiata. Известно, чтосозревание ооцита полностью зависит от окружающих клеток фолликулярногоэпителия, поставляющих в ооплазму РНК и белки, необходимые для развитиябудущего организма до включения его собственного генома, а также белковыефакторы, отвечающие за процесс оплодотворения. Было показано, что дозреваниеооцитов in Ditro со стадии GV до стадии МII при интактном cumulusпроисходило с большей вероятностью, причем последующее их оплодотворение идробление было лучше.Несмотря на расхождение данных, большинство авторов считает, чтопреинкубация обязательно необходима, а ее оптимальная длительностьподбирается эмпирически в каждой лаборатории. При этом окно оплодотворениядля зрелого ооцита достаточно широко, однако преждевременное оплодотворениенедозревших ооцитов может негативно повлиять на исход дробления и имплантацииэмбрионов.Помимо фактора времени, в инсеминации важным является и количественныйфактор. Количество прогрессивно подвижных сперматозоидов обычно должносоставлять 50 - 100 тыс. на 1 мл среды (при культивировании в относительнобольшом объеме среды) либо на ооцит (при культивировании в микрокаплях подминеральным маслом). Подбирая концентрацию сперматозоидов приоплодотворении ооцитов in vitro, нужно иметь в виду, что при добавлениименее 50 тыс. активно подвижных сперматозоидов на 1 мл частота оплодотворениябудет существенно снижена, а при использовании очень высоких концентрацийвозникают побочные эффекты: полиспермия (проникновение более одногосперматозоида в ооцит при оплодотворении), снижение жизнеспособностиполученных эмбрионов (за счет повреждения кислородными радикалами, припопадании погибающих или мертвых сперматозоидов, либо воздействияизбыточного количества литических акросомальных ферментов).Однако это правило реализуется лишь в случае нормальной морфологиисперматозоидов, при наличии необходимой концентрации активно подвижныхсперматозоидов в эякуляте, отсутствии дефектов акросомальной реакции илиотсутствии больших концентраций антиспермальных антител в сперме (MAR-тестменее 50%). При наличии этих и других отрицательных факторов, а также принеудаче оплодотворения в предыдущей попытке ЭКО концентрация сперматозоидовможет быть повышена путем снижения объема среды культивирования(культивирование в микрокаплях, соломках для криоконсервации,микрокапиллярах), однако это далеко не всегда приводит к желаемымрезультатам. Для облегчения проникновения сперматозоида в ооцит клеткиcumulus и corona radiata могут быть удалены ферментативно и механически,однако это повышает риск полиспермии.
