ОПЛОДОТВОРЕНИЕ – ТЕОРЕТИЧЕСКИЕ АСПЕКТЫ
Оплодотворение представляет собой слияние двух гамет - ооцита исперматозоида, влекущее за собой слияние их гаплоидных наборов хромосом иразвитие нового организма. Зрелый ооцит к моменту оплодотворения представляет собой одну изнаиболее больших клеток организма - 110 - 120 мкм в диаметре, окруженнуюблестящей оболочкой (zona pellucida), несколькими слоями клеток лучистого венца(corona radiata) и большим числом клеток яйценосного бугорка (cumulusoophorus). К этому времени в ооците, как правило, уже завершилось первоеделение мейоза, в результате которого отделилось первое полярное тельце, авторое деление мейоза находится на стадии метафазы. Хромосомы располагаются вряд, образуя метафазную пластинку, непосредственно под полярным тельцем. Наэтой стадии в ооците происходит блок мейоза, который снимается лишь припроникновении сперматозоида. Зрелый сперматозоид имеет уплощенную грушевидную головку длиной около 6мкм и шириной в экваториальном сегменте около 4 мкм, состоящую главным образомиз ядра и акросомы, которая содержит литические ферменты и расположена в видешапочки над верхней половиной головки. Хвост сперматозоида имеет длину около 50мкм и начинается от головки в районе шейки, где расположены центриоль икомплекс митохондрий. Митохондрии отвечают за обеспечение энергией процессадвижения сперматозоида, осуществляемого хвостом. В структуре сперматозоида нетничего лишнего, все имеет только одну цель – доставить генетический материал,содержащийся в головке сперматозоида, в ооцит.Способность сперматозоида к оплодотворению in vivo или In vitro появляетсялишь после капацитации, под которой in vivo понимается весь комплексбиохимических и ультраструктурных изменений, которые претерпеваетсперматозоид, проходя путь через женский половой тракт до встречи с ооцитом.Эти изменения затрагивают в основном мембрану головки сперматозоида.Капацитация in vitro происходит во время обработки и инкубирования спермы дооплодотворения, однако она невозможна при отсутствии в средах для отмывки икультивирования альбумина.При оплодотворении in vivo в трубе присутствует лишь небольшое количествосперматозоидов, проделавших весь долгий путь от влагалища до ампулярногоотдела маточной трубы. Для нормального оплодотворения in vitro их необходимоне менее 50 тыс. на ооцит. Однако при подсчете количества сперматозоидов,непосредственно атакующих ооцит in vitro, их насчитывается до 2 - 3 тыс. Досих пор неясно, почему количество сперматозоидов должно быть так велико вискусственных условиях. Возможно, это объясняется недостаточнойфизиологичностью среды либо большим размером массы cumulus у ооцитов,получаемых при ТВП, чем in vivo.Прежде чем попасть в ооцит, сперматозоид должен преодолеть несколькобарьеров. Первым из них является cumulus, представляющий собой растянутыйматрикс, состоящий преимущественно из полигиалуроновой кислоты, с редкорасположенными клетками. Преодолеть этот барьер может только капацитированныйсперматозоид с интактной акросомой. По мере продвижения внутрь cumulusповедение сперматозоида изменяется: резко возрастает скорость, двумерныедвижения становятся трехмерными - наступает фаза гиперактивности. In vitroпервый барьер сперматозоидам помогает преодолевать фермент гиалуронидаза,выделяющаяся при разрушении акросом гибнущих сперматозоидов; однако такаяситуация не является физиологичной.После прохождения cumulus сперматозоид достигает zona pellucida, гдепроисходит его связывание с рецептором. В отличие от мышей, рецепторы zоnаpellucida которых давно выделены и охарактеризованы, таковые человека до сихпор точно не определены. Имеется предположение, что это так называемыйантиген к оплодотворению - FA-1, гликопротеин, который при добавлении всреду полностью блокирует связывание сперматозоидов с zona pellucida.Связывание сперматозоида возможно только при интактной акросоме и нормальнойморфологии головки, поскольку рецепторы сперматозоида к гопа pellucidaрасположены на акросоме. Затем происходит акросомная реакция - мембранаакросомы и цитоплазматическая мембрана ооцита сливаются, содержимое акросомы(главным образом, фермент акрозин, способный к локальному растворениюгликопротеинов, из которых состоит гопа pellucida) выбрасывается в местесвязывания с гопа pellucida и сперматозоид интенсивно продвигается сквозьоболочку ооцита, все еще находясь в фазе гиперактивности.Попадая в перивителлиновое пространство, сперматозоид прикрепляется крецепторам на мембране ооцита комплементарными рецепторами, расположеннымина экваториальной части головки под акросомой. Связывание сперматозоида срецепторами на плазматической мембране мгновенно вызывает так называемуюкортикальную реакцию - массовый экзоцитоз гранул, расположенных по периферииооцита (cortex}, что приводит к необратимым изменениям zona pellucida,делающим ее непроходимой для остальных сперматозоидов. Это является основныммеханизмом предотвращения полиспермии у млекопитающих. Далее начинаетсяпроцесс слияния мембран сперматозоида и ооцита, в результате которогосперматозоид целиком как бы заглатывается ооцитом (процесс очень напоминаетфагоцитоз).Сразу после слияния гамет ядерная мембрана сперматозоида разрушается,хроматин деконденсируется под влиянием факторов ооплазмы. Одним из этихфакторов, возможно, является так называемый фактор деконденсации ядрасперматозоида (SNDF). Ооцит также активируется, мейоз возобновляется,выделяется второе полярное тельце. Механизм активации ооцита пока изученнедостаточно, однако известно, что фактор активации выделяетсясперматозоидом. Ядерный материал ооцита окружается оболочкой - формируетсяженский пронуклеус. Вокруг хроматина сперматозоида формируется мужскойпронуклеус, в обоих пронуклеусах идет синтез ДНК. Мужской и женскийпронуклеусы начинают движение по направлению друг к другу и встречаются вцентре ооцита. Через несколько часов после встречи мембраны пронуклеусовразрушаются, и генетический материал обеих гамет сливается (сингамия). Наэтом этапе процесс оплодотворения завершается - возникает зигота. Хроматинзиготы конденсируется, и хромосомы подготавливаются к первому делениюдробления.На следующий день после аспирации ооциты переносят в лунку со свежейкультуральной средой и очищают от клеток лучистого венца пастеровскойпипеткой с оттянутым до диаметра 150 - 160 мкм кончиком и просматривают напредмет присутствия признаков оплодотворения. Пронуклеусы видны в ооците дажепри наблюдении в стереомикроскоп х 80. Они появляются, как правило, через 10- 16 ч после добавления сперматозоидов в среду с ооцитами и исчезают через 6- 8 ч после появления. Если присутствуют оба пронуклеуса - оплодотворениесчитается нормальным. Если их не удается обнаружить - оплодотворение несостоялось. Если виден один пронуклеус либо больше двух - произошлоаномальное оплодотворение.Примерно в 30% случаев в ооцитах после оплодотворения in vitro не выявляютсяпронуклеусы, что может быть связано как с несостоявшейся пенетрацией ооцита(низкая концентрация активных сперматозоидов, дефекты в механизмах адгезиисперматозоида, отсутствие рецепторов на zona pellucida и/или мембранеооцита), так и с незрелостью ооцита на момент оплодотворения, а также сналичием хромосомных аномалий у ооцита (диплоидия, анеуплоидия).При наличии в ооплазме одного пронуклеуса (около 3 - 6%) в половине случаевоплодотворение все же происходит, однако пронуклеусы формируются асинхронно.Происхождение таких зигот может быть различным: гиногенетическим (изооцита), андрогенетическим (из сперматозоида) либо возникшим в результатеслияния мужского и женского пронуклеусов. Отличить на практике этоневозможно, поэтому рекомендуется: во-первых, просматривать ооциты наследующий день после инсеминации несколько раз, чтобы избежать ошибки; во-вторых, не переносить в полость матки эмбрионы, полученные изоднопронуклеарных зигот.Полипронуклеарные зиготы - 3 и более пронуклеусов - составляют, как правило,5 - 10% от всех оплодотворенных ооцитов и возникают главным образом припроникновении в ооцит более одного сперматозоида (в случае добавленияизбыточного количества сперматозоидов при инсеминации, при дефектахкортикальной реакции, при незрелости или перезрелости ооцита). Также описаныслучаи неотделения второго полярного тельца после завершения мейоза,генетический материал которого формирует третий пронуклеус.Полипронуклеарные зиготы, как правило, не развиваются нормально, эмбрионы,полученные из таких зигот нельзя переносить в полость матки. В естественныхусловиях такие эмбрионы иногда имплантируются, однако чаще всего такаябеременность заканчивается выкидышем либо мертворождением.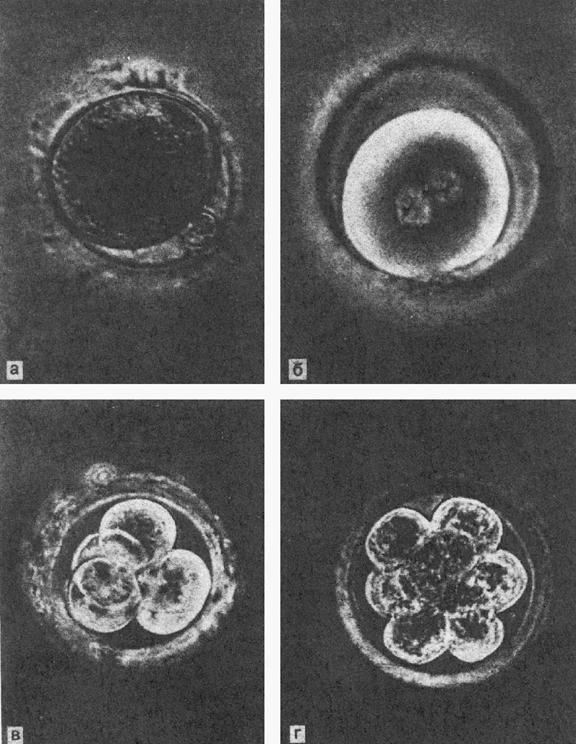 Рис. 4. Яйцеклетки и зародыши человека на различных этапах культивирования.а – ооцит с первым полярным тельцем; б – пронуклеусы: в и г – зародыши настадиях 4 и 8 бластомеров. Микрофотографии живых объектов в фазовомконтрасте. ОЦЕНКА КАЧЕСТВА ЭМБРИОНОВ Эмбрионы, полученные после оплодотворения ооцитов одной и той же пациентки,часто отличаются по скорости дробления и морфологическим параметрам.Общепризнанным считается, что максимальную способность к имплантации имеютэмбрионы с наибольшей скоростью дробления, бластомеры которых имеютрегулярную форму, а безъядерные фрагменты отсутствуют. Такие эмбрионы относятк классу 1 (А). Градация эмбрионов по качеству является условной иразличается в разных лабораториях. Однако в основе ее лежит, как правило,характер фрагментации эмбриона, форма и размер бластомеров. Так, эмбрион снеравными бластомерами и/или фрагментами цитоплазмы, занимающими менее 10%объема, соответствует классу 2 (В); при наличии фрагментации 10 - 50% -классу 3 (С), более 50% - классу 4 (D).Работы по анализу влияния качества переносимых в полость матки эмбрионов начастоту их имплантации многочисленны, но трудносопоставимы в силу разныхметодик оценки качества. Около 20% переносимых эмбрионов А-В классаимплантируются, однако эта частота падает до 1,5% для сильнофрагментированных эмбрионов. Впечатляют результаты клиники Bourn Hall(Англия), в которых показано, что 90% пациенток, забеременевших после ЭКО иПЭ, получали при переносе эмбрионов хотя бы один эмбрион класса А. В той жеработе не было выявлено зависимости между качеством переносимых эмбрионов ичастотой невынашивания беременности. СТРАТЕГИЯ ПЕРЕНОСА ЭМБРИОНОВ Количество переносимых эмбрионов обычно составляет не более 2 - 3, посколькупри увеличении числа эмбрионов до 4 и более частота беременности, какправило, не возрастает, но увеличивается риск моногоплодной беременности, чтовлечет за собой серьезные проблемы акушерского характера. Однако вотдельных случаях допускается перенос большего числа эмбрионов - примногократных неудачных попытках ЭКО и ПЭ и при возрасте пациентки старше 40лет. В данном случае при последующих переносах шанс наступления беременностиснижается, и авторы пытаются использовать возможность наступлениябеременности за счет увеличения количества переносимых эмбрионов. Но такойподход не является научным, так как в этих случаях не всегда ясна причинанеудач, т. е. мы часто имеем дело с так называемым «бесплодием неяснойэтиологии».Что касается интервала между моментом оплодотворения ооцитов и временемпереноса эмбрионов, то здесь существует несколько основных подходов. На зареразвития метода Эдварде и Стептоу переносили в полость матки эмбрионы,достигшие стадии 8 - 16 бластомеров на 3 - 4-е сутки культивирования,имитируя естественные условия. Однако впоследствии было выявлено, что болееранние эмбрионы также пригодны для переноса и имплантируются с той жевероятностью.Через 48 ч после аспирации фолликулов (2-е сутки культивирования) эмбрионы,как правило, находятся на стадии 2 - 4 бластомеров, но встречаются и стадии 6- 8 бластомеров. Перенос эмбрионов на 2-е сутки наиболее общепринят: ужеимеется возможность отобрать эмбрионы по качеству и скорости дробления,однако пребывание в условиях культуры, являющихся в любом случае менееоптимальными, чем естественные, еще не слишком длительно.Интересен тот факт, что способность эмбриона к имплантации напрямую зависитот скорости его дробления. Так, в исследовании Staessen с соавт. припереносе эмбриона хорошего качества на стадии 2 и 4 бластомеров частотаимплантации составила 14 и 21% соответственно. В другой работе сообщается,что если перенесенные эмбрионы достигали стадии не более 2 бластомеров,частота наступления беременности составляла 9,3%, но возрастала до 35,8%,если хотя бы один эмбрион был на более чем двуклеточной стадии.На 3-и сутки культивирования нормально развивающиеся эмбрионы достигаютстадии 6 - 8 бластомеров и выше. К этому моменту выбор эмбрионов дляпереноса облегчается - часть эмбрионов, на 2-е сутки дробившихся нормально,отстает в развитии либо останавливается. Однако при анализе качествамногоклеточных эмбрионов существует опасность принять безъядерные фрагментыза бластомеры, становящиеся к этой стадии близкими по размеру. В большинствелабораторий, проводящих ЭКО и ПЭ, перенос эмбрионов осуществляется на 2 - 3-и сутки культивирования, причем статистически достоверной разницы междучастотой наступления беременности после переноса на 2-е или 3-и сутки не былообнаружено (соответственно 21,9 и 23,5%). Выбор времени переноса долженосуществляться на основании анализа интенсивности и равномерности дробленияэмбрионов: если выбор эмбрионов на 2-е сутки затруднен, перенос можноотложить на 24 ч.На 4 - 5-е сутки пребывания в культуре при применении стандартных сред иметодик культивирования лишь небольшая часть эмбрионов достигает стадииморулы и бластоцисты, и частота наступления беременности не возрастает посравнению с переносом на 2 - 3-и сутки.Однако при использовании культуральных систем, отвечающих метаболическимпотребностям эмбрионов на этой стадии, можно добиться хороших результатов.Так, при культивировании эмбрионов в присутствии клеток линии Vero (клеткипочки обезьяны) было показано, что 60% эмбрионов достигают стадиибластоцисты, а перенос бластоцист дает высокий процент беременности.Особенно это относится к пациенткам с повторными неудачами при переносе болееранних эмбрионов. По данным разных авторов, беременность наступала в 37 - 40%случаев переноса эмбрионов на стадии бластоцисты.Серьезным возражением против ко-культивирования эмбрионов человека в присутствииклеток других животных является возможность вирусного заражения, поэтомуактивно разрабатываются среды, оптимизирующие условия культивирования болеепоздних эмбрионов (>3 суток). Примером такой среды может служить средаГарднера (G 2). При культивировании в ней эмбрионов с 3-го по 5-й деньбластоцисты формировались из 52% зигот первого дня, частота имплантации ибеременности составляла соответственно 23 и 38%. Сам Гарднер сообщает о 50%-йимплантации бластоцист, полученных при последовательном культивировании всредах G 1,2 (1 - 2-й день) и G 2,2 (3 - 5-й день), в то время как достовернойразницы между частотой наступления беременности после переноса эмбрионов на 3-й и 5-е сутки не наблюдалось (66 и 71% соответственно). Возможность культивирования до стадии бластоцисты открывает большиевозможности при отборе «лучших» эмбрионов, делает более физиологичныммомент попадания эмбрионов в полость матки, а также существенно увеличиваетпроцент имплантации, что позволяет переносить не более 2 бластоцист, неопасаясь возникновения осложнений, связанных с многоплодием, или снижениявероятности наступления беременности. ТЕХНИКА ПЕРЕНОСА ЭМБРИОНОВ Техника переноса эмбрионов за двадцать лет развития метода практически неизменилась. Здесь мы рассмотрим лишь последовательность действий эмбриолога,не касаясь гинекологических аспектов переноса.Перенос эмбрионов осуществляют через цервикальный канал в полость маткипациентки с помощью специального катетера. Существует большой выбор такихкатетеров, однако наиболее распространенными в мире являются: катетеры Bourn-Wallace, Frydman и Cook-Soft transfer для неосложненных переносов и катетерT.D.T. для осложненных переносов (при загибе матки, извилистом ходе илиспазме цервикального канала).Катетер присоединяют к 1-миллилитровому шприцу, набирают столбик (около 0,2мл) свежей, нагретой до 37°С культуральной среды, затем давление со шприцаснимают, шприц переводят в исходное положение и продолжают набирать: сначалапузырек воздуха, затем каплю среды без эмбрионов, опять пузырек воздуха,каплю среды с эмбрионами, отобранными для переноса, пузырек воздуха и ещеодну каплю без эмбрионов. Такая последовательность необходима для обеспечениясохранности эмбрионов во время процедуры переноса и маркирования ихместоположения. Катетер с эмбрионами передают гинекологу для осуществленияпереноса: содержимое, за исключением начального столбика среды, всего около20 - 50 мкл, попадает в полость матки. Оставшейся средой промывают катетер исмыв рассматривают под стереомикроскопом, чтобы убедиться, что все эмбрионыперенесены в полость матки. СТИМУЛЯЦИЯ СУПЕРОВУЛЯЦИИ В ПРОГРАММЕ ЭКО И ПЭ Для успешного выполнения программы ЭКО необходимо добиться созреваниянескольких доминантных фолликулов - суперовуляции. Это значительно повышаетвозможность изъятия и оплодотворения яйцеклетки. Кроме того, отмечено, чтопри пересадке нескольких оплодотворенных яйцеклеток беременность развиваетсячаще, причем развивается один эмбрион. Этот феномен получил название "функцияпомощи".Период развития от раннего преантрального до преовуляторного фолликула учеловека занимает примерно 85 дней, или 3 менструальных цикла (рис.5). После65 дней роста финальная когорта, состоящая из 15 - 20 малых полостныхфолликулов, вступает в гонадотропинзависимую фазу роста. В спонтанномменструальном цикле в яичнике под влиянием гонадотропинов (Гн), главнымобразом фолликулостимулирующего гормона (ФСГ), развивается один фолликул, аостальные подвергаются атрезии. Секреция ФСГ происходит в аденогипофизе ирегулируется гонадотропин-рилизинг гормоном (ГнРГ), вырабатываемымгипоталамусом. Доминантный фолликул обладает высокой стероидогеннойактивностью и продуцирует эстрадиол (Е2), необходимый для секреторнойтрансформации эндометрия и обеспечения условий для имплантации эмбриона.Когда секреция E2 достигает критического уровня, происходит резкоевозрастание уровня лютеинизирующего гормона (ЛГ), стимулирующего овуляцию илютеинизацию лопнувшего фолликула. ЛГ, как и ФСГ, секретируется клеткамиаденогипофиза и находится под влиянием ГнРГ. Изучение динамики концентрацииE2 в периферической крови показало, что период активного стероидогенезасоставляет 5 - 6 дней, после чего концентрация е2 резко снижается.Мониторниг E2 используется в клинической практике для определения степенифункциональной зрелости доминантного фолликула. На месте разорвавшегосяфолликула формируется желтое тело, которое является основнойстероидпродуцирующей структурой яичника, определяющей изменения концентрацииЕ2 и прогестерона (П) на протяжении лютеиновой фазы менструального цикла.Первая беременность, завершившаяся в 1978 г. рождением Луизы Браун, наступилав результате оплодотворения in vitro единственного ооцита, аспирированного вспонтанном цикле, и переноса одного эмбриона в полость матки. В последующихисследованиях была показана низкая эффективность метода при переносе лишьодного эмбриона, которая составляет при работе в естественном цикле не более8 - 15% из расчета на один перенос эмбрионов. Это привело к необходимостииспользования лекарственных препаратов, оказывающих стимулирующее действие нафолликулогенез в яичниках в целях получения нескольких преовуляторныхооцитов.Для стимуляции фолликулогенеза и получения нескольких преовуляторных ооцитовиспользуются гормональные препараты.
Рис. 4. Яйцеклетки и зародыши человека на различных этапах культивирования.а – ооцит с первым полярным тельцем; б – пронуклеусы: в и г – зародыши настадиях 4 и 8 бластомеров. Микрофотографии живых объектов в фазовомконтрасте. ОЦЕНКА КАЧЕСТВА ЭМБРИОНОВ Эмбрионы, полученные после оплодотворения ооцитов одной и той же пациентки,часто отличаются по скорости дробления и морфологическим параметрам.Общепризнанным считается, что максимальную способность к имплантации имеютэмбрионы с наибольшей скоростью дробления, бластомеры которых имеютрегулярную форму, а безъядерные фрагменты отсутствуют. Такие эмбрионы относятк классу 1 (А). Градация эмбрионов по качеству является условной иразличается в разных лабораториях. Однако в основе ее лежит, как правило,характер фрагментации эмбриона, форма и размер бластомеров. Так, эмбрион снеравными бластомерами и/или фрагментами цитоплазмы, занимающими менее 10%объема, соответствует классу 2 (В); при наличии фрагментации 10 - 50% -классу 3 (С), более 50% - классу 4 (D).Работы по анализу влияния качества переносимых в полость матки эмбрионов начастоту их имплантации многочисленны, но трудносопоставимы в силу разныхметодик оценки качества. Около 20% переносимых эмбрионов А-В классаимплантируются, однако эта частота падает до 1,5% для сильнофрагментированных эмбрионов. Впечатляют результаты клиники Bourn Hall(Англия), в которых показано, что 90% пациенток, забеременевших после ЭКО иПЭ, получали при переносе эмбрионов хотя бы один эмбрион класса А. В той жеработе не было выявлено зависимости между качеством переносимых эмбрионов ичастотой невынашивания беременности. СТРАТЕГИЯ ПЕРЕНОСА ЭМБРИОНОВ Количество переносимых эмбрионов обычно составляет не более 2 - 3, посколькупри увеличении числа эмбрионов до 4 и более частота беременности, какправило, не возрастает, но увеличивается риск моногоплодной беременности, чтовлечет за собой серьезные проблемы акушерского характера. Однако вотдельных случаях допускается перенос большего числа эмбрионов - примногократных неудачных попытках ЭКО и ПЭ и при возрасте пациентки старше 40лет. В данном случае при последующих переносах шанс наступления беременностиснижается, и авторы пытаются использовать возможность наступлениябеременности за счет увеличения количества переносимых эмбрионов. Но такойподход не является научным, так как в этих случаях не всегда ясна причинанеудач, т. е. мы часто имеем дело с так называемым «бесплодием неяснойэтиологии».Что касается интервала между моментом оплодотворения ооцитов и временемпереноса эмбрионов, то здесь существует несколько основных подходов. На зареразвития метода Эдварде и Стептоу переносили в полость матки эмбрионы,достигшие стадии 8 - 16 бластомеров на 3 - 4-е сутки культивирования,имитируя естественные условия. Однако впоследствии было выявлено, что болееранние эмбрионы также пригодны для переноса и имплантируются с той жевероятностью.Через 48 ч после аспирации фолликулов (2-е сутки культивирования) эмбрионы,как правило, находятся на стадии 2 - 4 бластомеров, но встречаются и стадии 6- 8 бластомеров. Перенос эмбрионов на 2-е сутки наиболее общепринят: ужеимеется возможность отобрать эмбрионы по качеству и скорости дробления,однако пребывание в условиях культуры, являющихся в любом случае менееоптимальными, чем естественные, еще не слишком длительно.Интересен тот факт, что способность эмбриона к имплантации напрямую зависитот скорости его дробления. Так, в исследовании Staessen с соавт. припереносе эмбриона хорошего качества на стадии 2 и 4 бластомеров частотаимплантации составила 14 и 21% соответственно. В другой работе сообщается,что если перенесенные эмбрионы достигали стадии не более 2 бластомеров,частота наступления беременности составляла 9,3%, но возрастала до 35,8%,если хотя бы один эмбрион был на более чем двуклеточной стадии.На 3-и сутки культивирования нормально развивающиеся эмбрионы достигаютстадии 6 - 8 бластомеров и выше. К этому моменту выбор эмбрионов дляпереноса облегчается - часть эмбрионов, на 2-е сутки дробившихся нормально,отстает в развитии либо останавливается. Однако при анализе качествамногоклеточных эмбрионов существует опасность принять безъядерные фрагментыза бластомеры, становящиеся к этой стадии близкими по размеру. В большинствелабораторий, проводящих ЭКО и ПЭ, перенос эмбрионов осуществляется на 2 - 3-и сутки культивирования, причем статистически достоверной разницы междучастотой наступления беременности после переноса на 2-е или 3-и сутки не былообнаружено (соответственно 21,9 и 23,5%). Выбор времени переноса долженосуществляться на основании анализа интенсивности и равномерности дробленияэмбрионов: если выбор эмбрионов на 2-е сутки затруднен, перенос можноотложить на 24 ч.На 4 - 5-е сутки пребывания в культуре при применении стандартных сред иметодик культивирования лишь небольшая часть эмбрионов достигает стадииморулы и бластоцисты, и частота наступления беременности не возрастает посравнению с переносом на 2 - 3-и сутки.Однако при использовании культуральных систем, отвечающих метаболическимпотребностям эмбрионов на этой стадии, можно добиться хороших результатов.Так, при культивировании эмбрионов в присутствии клеток линии Vero (клеткипочки обезьяны) было показано, что 60% эмбрионов достигают стадиибластоцисты, а перенос бластоцист дает высокий процент беременности.Особенно это относится к пациенткам с повторными неудачами при переносе болееранних эмбрионов. По данным разных авторов, беременность наступала в 37 - 40%случаев переноса эмбрионов на стадии бластоцисты.Серьезным возражением против ко-культивирования эмбрионов человека в присутствииклеток других животных является возможность вирусного заражения, поэтомуактивно разрабатываются среды, оптимизирующие условия культивирования болеепоздних эмбрионов (>3 суток). Примером такой среды может служить средаГарднера (G 2). При культивировании в ней эмбрионов с 3-го по 5-й деньбластоцисты формировались из 52% зигот первого дня, частота имплантации ибеременности составляла соответственно 23 и 38%. Сам Гарднер сообщает о 50%-йимплантации бластоцист, полученных при последовательном культивировании всредах G 1,2 (1 - 2-й день) и G 2,2 (3 - 5-й день), в то время как достовернойразницы между частотой наступления беременности после переноса эмбрионов на 3-й и 5-е сутки не наблюдалось (66 и 71% соответственно). Возможность культивирования до стадии бластоцисты открывает большиевозможности при отборе «лучших» эмбрионов, делает более физиологичныммомент попадания эмбрионов в полость матки, а также существенно увеличиваетпроцент имплантации, что позволяет переносить не более 2 бластоцист, неопасаясь возникновения осложнений, связанных с многоплодием, или снижениявероятности наступления беременности. ТЕХНИКА ПЕРЕНОСА ЭМБРИОНОВ Техника переноса эмбрионов за двадцать лет развития метода практически неизменилась. Здесь мы рассмотрим лишь последовательность действий эмбриолога,не касаясь гинекологических аспектов переноса.Перенос эмбрионов осуществляют через цервикальный канал в полость маткипациентки с помощью специального катетера. Существует большой выбор такихкатетеров, однако наиболее распространенными в мире являются: катетеры Bourn-Wallace, Frydman и Cook-Soft transfer для неосложненных переносов и катетерT.D.T. для осложненных переносов (при загибе матки, извилистом ходе илиспазме цервикального канала).Катетер присоединяют к 1-миллилитровому шприцу, набирают столбик (около 0,2мл) свежей, нагретой до 37°С культуральной среды, затем давление со шприцаснимают, шприц переводят в исходное положение и продолжают набирать: сначалапузырек воздуха, затем каплю среды без эмбрионов, опять пузырек воздуха,каплю среды с эмбрионами, отобранными для переноса, пузырек воздуха и ещеодну каплю без эмбрионов. Такая последовательность необходима для обеспечениясохранности эмбрионов во время процедуры переноса и маркирования ихместоположения. Катетер с эмбрионами передают гинекологу для осуществленияпереноса: содержимое, за исключением начального столбика среды, всего около20 - 50 мкл, попадает в полость матки. Оставшейся средой промывают катетер исмыв рассматривают под стереомикроскопом, чтобы убедиться, что все эмбрионыперенесены в полость матки. СТИМУЛЯЦИЯ СУПЕРОВУЛЯЦИИ В ПРОГРАММЕ ЭКО И ПЭ Для успешного выполнения программы ЭКО необходимо добиться созреваниянескольких доминантных фолликулов - суперовуляции. Это значительно повышаетвозможность изъятия и оплодотворения яйцеклетки. Кроме того, отмечено, чтопри пересадке нескольких оплодотворенных яйцеклеток беременность развиваетсячаще, причем развивается один эмбрион. Этот феномен получил название "функцияпомощи".Период развития от раннего преантрального до преовуляторного фолликула учеловека занимает примерно 85 дней, или 3 менструальных цикла (рис.5). После65 дней роста финальная когорта, состоящая из 15 - 20 малых полостныхфолликулов, вступает в гонадотропинзависимую фазу роста. В спонтанномменструальном цикле в яичнике под влиянием гонадотропинов (Гн), главнымобразом фолликулостимулирующего гормона (ФСГ), развивается один фолликул, аостальные подвергаются атрезии. Секреция ФСГ происходит в аденогипофизе ирегулируется гонадотропин-рилизинг гормоном (ГнРГ), вырабатываемымгипоталамусом. Доминантный фолликул обладает высокой стероидогеннойактивностью и продуцирует эстрадиол (Е2), необходимый для секреторнойтрансформации эндометрия и обеспечения условий для имплантации эмбриона.Когда секреция E2 достигает критического уровня, происходит резкоевозрастание уровня лютеинизирующего гормона (ЛГ), стимулирующего овуляцию илютеинизацию лопнувшего фолликула. ЛГ, как и ФСГ, секретируется клеткамиаденогипофиза и находится под влиянием ГнРГ. Изучение динамики концентрацииE2 в периферической крови показало, что период активного стероидогенезасоставляет 5 - 6 дней, после чего концентрация е2 резко снижается.Мониторниг E2 используется в клинической практике для определения степенифункциональной зрелости доминантного фолликула. На месте разорвавшегосяфолликула формируется желтое тело, которое является основнойстероидпродуцирующей структурой яичника, определяющей изменения концентрацииЕ2 и прогестерона (П) на протяжении лютеиновой фазы менструального цикла.Первая беременность, завершившаяся в 1978 г. рождением Луизы Браун, наступилав результате оплодотворения in vitro единственного ооцита, аспирированного вспонтанном цикле, и переноса одного эмбриона в полость матки. В последующихисследованиях была показана низкая эффективность метода при переносе лишьодного эмбриона, которая составляет при работе в естественном цикле не более8 - 15% из расчета на один перенос эмбрионов. Это привело к необходимостииспользования лекарственных препаратов, оказывающих стимулирующее действие нафолликулогенез в яичниках в целях получения нескольких преовуляторныхооцитов.Для стимуляции фолликулогенеза и получения нескольких преовуляторных ооцитовиспользуются гормональные препараты.  Рис. 5. Цикл развития доминантного фолликула Стимуляция суперовуляции в современных условиях основана на:§ стимуляции выделения собственных эндогенных гонадотропинов кломифеном;§ стимуляции экзогенными гонадотропинами (препараты из мочименопаузальных женщин - препараты человеческого менопаузального гонадотропина(чМГ), содержащие ЛГ и ФСГ (пергонал, неопергонал, хумегон) или ФСГ(метродин);§ стимуляции экзогенными гонадотропинами на фоне блокады собственныхгонадотропинов препаратами агонистов РГ ЛГ (декапептиды - трипторелин,бусерелин, госерелин, нафарелин и др.). Все эти препараты - синтетическиеаналоги гонадотропных рилизинг гормонов, и число их постоянно растет. Все онив 50 - 100 раз активнее эндогенных рилизингов. Действие их основано наблокаде собственных гонадотропинов, что позволило некоторым авторам называтьэтот метод «стимуляция суперовуляции на фоне гипофизэктомии», хотя на самомделе подавляется секреция только гонадотропинов, а не всех тропныхгипофизарных гормонов. На фоне снижения уровня собственных гонадотропиноввведение экзогенных гонадотропинов позволяет регулировать рост доминантныхфолликулов и созревание яйцеклеток.В повседневной практике используются так называемые «длинная схема» и«короткая схема» введения препаратов.При длинной схеме введение агонистов начинают в конце фолликулярной фазыпредыдущего цикла, под контролем снижения ЛГ в крови. После наступленияустойчивого низкого «плато» ЛГ приступают к введению гонадотропныхпрепаратов. При короткой схеме агонисты вводятся с 1-го дня менструальногоцикла, гонадотропины - с 3-го или 5-го дня цикла.При любом методе стимуляции суперовуляции постоянно контролируются числофолликулов, темпы их роста и величина фолликулов. До начала стимуляциисуперовуляции следует проводить предварительное гормональное обследование, ав период стимуляции - ультразвуковой (УЗ) и гормональный мониторинг. Какправило, исследуется уровень эстрадиола крови и толщина эндометрия.Критериями созревания яйцеклетки, точнее говоря, определением времени,оптимального для забора ооцитов, являются: концентрация эстрадиола не менее350 пг/мл на 1 фолликул диаметром более 15 мм, толщина эндометрия 0,8 - 1,0см.Механизм овуляции, в естественном спонтанном менструальном циклеобеспечивающийся выбросом эндогенного ЛГ, в циклах стимуляции суперовуляцииимитируется введением ЛГ-подобного препарата - хорионического гонадотропина(ХГ), получаемого из мочи беременных женщин.Через 35 - 36 ч после введения овуляторной дозы ХГ (10000 ед.) производитсятрансвагинальная пункция яичников (ТВП) в целях аспирации зрелых ооцитов.После их оплодотворения in vitro и инкубации в специальной питательной средечерез 48 - 72 ч, в зависимости от интенсивности дробления, производитсяперенос эмбрионов на ранней стадии дробления в полость матки пациентки.После пересадки эмбрионов рекомендуется вводить поддерживающие дозыхорионического гонадотропина по 1500 ед. и дексаметазона по 0,25 мг,последний подавляет иммунную реакцию отторжения плодного яйца. Препаратывводят до констатации беременности или до срока очередных менструаций (вслучае неудачи). ОСНОВНЫЕ ПРОБЛЕМЫ, ВОЗНИКАЮЩИЕ ПРИ ПРИМЕНЕНИИ ЭКО И ПЭ Программа ЭКО и ПЭ сложна в связи с тем, что она многоэтапная, но не всеэтапы можно объективно проконтролировать. Остановимся на некоторыхпроблемах, возникающих при применении этого метода.У женщины вовремя одного естественного менструального цикла можно получить всреднем не более одной яйцеклетки. Манипулируя с яйцеклеткой, ее легкопотерять или травмировать, поскольку ее размеры, включая corona radiata, непревышают 500 мк. Яйцеклетка может быть потеряна, например, в пипетке, вкапле питательной среды и т. п. Следовательно, необходим резерв клеток.В связи с этим возникла идея стимуляции так называемой суперовуляции, т. е.получения большего числа яйцеклеток (5 - 10 шт.) за счет примененияантагонистов эстрогенов и менопаузальных гонадотропинов ФСГ и ЛГ. Однакоувеличение количества яйцеклеток влечет за собой другой отрицательныйфактор - некоторые из них могут оказаться неполноценными, с нарушениемоогенеза или с хромосомной патологией, а другие могут стать на путь обратногоразвития в процессе фолликулогенеза. Так что не все полученные яйцеклеткимогут быть оплодотворены и нормально развиваться.Высокая частота самопроизвольных абортов (26,2%) после ЭКО являетсяотносительным показателем возможной патологии плодов. Эти данныеподтверждаются результатами исследования хромосом яйцеклеток и эмбрионовранних стадий развития. Известно, что от 35 до 50% нефертилизованных ооцитовв программе ЭКО имеют хромосомные аномалии. Выявлена высокая степеньзависимости хромосомных аномалий от возраста беременных женщин. Так,анэуплоидия диагностируется у 47% женщин после 35, лет и у 25% молодыхженщин; после кломифена - у 55%, после ЧМГ - у 23%, после чистого ФСГ - у22%. Значительно чаще хромосомная патология обнаруживается уфрагментированных эмбрионов (33%), чем у нормальных (20%).Анализ ооцитов и эмбрионов, полученных в программе ЭКО, свидетельствует отом, что основным фактором, обусловливающим высокую частоту хромосомныханомалий, является возраст беременных. Увеличение частоты хромосомнойпатологии с увеличением возраста имеет тенденцию, аналогичную таковой впопуляции, однако показатели этой патологии в 2 раза выше, чем популяционныеданные спонтанной фертильности. Высокая частота хромосомных аномалий внефертилизованных ооцитах свидетельствует о том, что множественная наведеннаястимуляцией овуляция, или суперовуляция, сопровождается высокой частотойхромосомной патологии ооцитов, которые созревают в аномальных условиях вотсутствие физиологической селекции и борьбы за существование доминирующегофолликула, который подавляет рост других фолликулов в одном пуле, возможно,не имеющих тенденции к нормальному развитию.Начато внедрение в практику методики флуорисцентной (in situ) гибридизации(FISH), обеспечивающей преимплантационную диагностику врожденной хромосомнойпатологии. Отдельные бластомеры извлекаются из эмбриона и проводится их FISH-анализ. Эмбрионы, по которым получено положительное заключение, могут бытьперенесены в полость матки для дальнейшего развития, а эмбрионы собнаруженной патологией не переносятся (в целях профилактики такихзаболеваний как гемофилия, синдром Патау, Дауна, Эдвардса, Клайнфельтера,моносомия Шершевского-Тернера).Достижением самых последних лет является генная терапия, применение которойвозможно и на самых ранних стадиях развития эмбрионов. При этом выполняетсяне только диагностика, но и лечение больных зародышей.Особенностью ЭКО является очень высокая частота многоплодных беременностей.Если при естественном зачатии рождается одна двойня на 70 - 80 родов, однатройня на 9000 родов и одна четверня на 50 000 родов, то после ЭКОмногоплодие, включая двойни, тройни и четверни, встречается примерно вполовине(!) всех беременностей. Хорошо известно, что многоплодие, особеннокогда беременность больше, чем двумя плодами, создает высокий риск осложненийи для матери, и для ребенка, как в процессе беременности, так и родов.Сегодня разработаны способы удаления (редукции) "лишних" плодов (больше двух)под ультразвуковым контролем. На самом деле лишние плоды не удаляют, а путемвведения специальных растворов добиваются того, что они перестают развиватьсяи постепенно рассасываются. Эта процедура производится на 7 - 8-й неделебеременности и, как правило, не сопровождается угрозой выкидыша остальныхплодов. Рассасывание лишних плодов может происходить и само по себе, безкаких-либо вмешательств, также до 7 - 8 нед.Имеются данные о возможности возникновения y человека таких «ошибокоплодотворения», как гино- и андрогенез.В программе ЭКО и ПЭ, к сожалению, присутствует возможность возникновенияряда грозных осложнений акушерско-гинекологического характера, которыесуществуют и в естественных условиях. Основное из них - внематочнаябеременность, которая может наступить, даже если маточные трубы у женщинынепроходимы, а также в случае, если они удалены недостаточно радикально(беременность наступает в культях труб). Вероятность наступления внематочнойбеременности в программе ЭКО и ПЭ 10,6%.Следует также знать, что нередко при лечении бесплодия методом ЭКО можетиметь место такое осложнение как синдром гиперстимуляции яичников (СГЯ).Синдром гиперстимуляции яичников (СГЯ) - комплекс патологических симптомов,возникающих на фоне применения стимуляторов овуляции, характеризующийсязначительным увеличением яичников, иногда разрывом их и кровотечением;наличием выпота в брюшной и плевральной полостях, возникновениемтромбоэмболий магистральных сосудов, многоплодной беременностью и пр.В последние годы, в связи с широким распространением лечения бесплодияметодом экстракорпорального оплодотворения, включающего как первый этапстимуляцию суперовуляции, СГЯ привлекает все большее внимание. Первыеописания СГЯ появились еще в 40-х годах, S. Ridberg сообщил о значительномувеличении яичников после применения гонадотропинов. В 1962 г. A. Southan,N. Ivanovsky опубликовали случаи СГЯ после приема значительных доз кломифена:в 1970 г. описаны случаи СГЯ при комбинированной терапии кломифеном игонадотропинами [Roland M.].Е. Raban и соавт. в 1967 г. предложили классификацию СГЯ, которой пользуютсядо сих пор все клиницисты:• легкая форма,• средней тяжести,• тяжелая.Данные о частоте СГЯ приводит Н. Li в 1993 г. в сборнике, посвященномусловиям репродуктивной медицины:— частота легкой формы достигает 23%,— средней тяжести - 10%,— тяжелой - 2%.J. Shenker, D. Weinstein расширили и детализировали классификацию, выделив вкаждой из трех форм еще две степени. Легкая форма:1-я степень - клиническая симптоматика отсутствует, содержаниеэстрадиола в плазме более 150 мкг, в моче прегнадиола выше 10 мг;2-я степень- к этим биохимическим изменениям присоединяется увеличение яичников до 5см в диаметре. Форма средней тяжести:3-я степень - боли, чувство тяжести внизу живота и изменения,описанные во 2-й степени;4-я степень - присоединяется тошнота, рвота, понос, размерыяичников - более 5 см в диаметре. Тяжелая форма:5-я степень - к описанным симптомам присоединяется асцит,гидроторакс, яичники более 12 см в диаметре;6-я степень - состояние крайне тяжелое, помимо асцита и гидротораксаразвивается гиперкоагуляция, уменьшается перфузия почек, осложняющаясяолигурией и почечной недостаточностью, яичники резко увеличены, отмечают ихразрывы и перекрут.Суммируя представленные данные, можно сказать, что, по-видимому, используемыев программах вспомогательной репродукции способы гормональной стимуляциифолликулогенеза и овуляции вносят свой вклад в увеличение числа такихошибок. Гибель зародышей в процессе имплантации может быть обусловленаперечисленными выше причинами, недостаточностью второй фазы цикла(изначально существовавшей или возникшей в процессе овариальной стимуляции),а также, возможно, особенностями становления иммунологических отношенийэмбриона с организмом матери, вследствие отсутствия трубного периодаразвития, в который эти отношения начинают активно устанавливаться («факторранней беременности» и т.п.).Трудно оценить влияние на гаметогенез и оплодотворение чисто внешних(экологических, антропогенных, социокультурных и т. п.) факторов. Однако они,безусловно, также вносят свой вклад в патологию раннего развития.Таким образом, в большинстве случаев пренатальные потери и приводящая к нимпатология у эмбрионов при использовании методов вспомогательной репродукциивозникают не необходимо и не случайно, а под влиянием определенных факторов,в том числе и приводящих к нарушению регулирующих репродуктивный процессмеханизмов. Элиминация же аномальных гамет, зигот и эмбрионов - процесс какнеобходимый, так и закономерный, направленный на сохранение постоянствагенотипа популяции. ЗАКЛЮЧЕНИЕ Проблема бесплодия возникла отнюдь не сегодня, она сопровождает человечествоеще с древних времен. Современная медицина достаточно глубоко изучила причинывозникновения женского и мужского бесплодия. Разработаны как лекарственные,т.е. консервативные, методы терапии бесплодия, так и оперативные.Однако неудовлетворенность достигнутыми результатами привела к разработкенового метода лечения бесплодия - ЭКО и ПЭ, который быстро завоевал позициюлидирующего в этом направлении.В данной работе представлены основные проблемы программы ЭКО и ПЭ и возможныеосложнения, возникающие на различных ее этапах.Хотя применение метода ЭКО и ПЭ не позволяет в целом решить возникшую встране критическую демографическую ситуацию, тем не менее широкое внедрениеего в практику здравоохранения поможет избавиться от бесплодия сотням тысячсупружеских пар, а следовательно, осуществить также их психологическуюреабилитацию.В заключение необходимо отметить, что благодаря успехам программы ЭКОдостигнуты положительные результаты в фундаментальных исследованияхчеловеческих гамет и эмбрионов. ЛИТЕРАТУРА 1. Экстракорпоральное оплодотворение и его новые направления в леченииженского бесплодия (теоретические и практические подходы): Руководство дляврачей / Под. ред. В.И.Кулакова, Б.В.Леонова – М., 2001, 782 с.2. Никитин А.И., Китаев Э.М., Савицкий Г.А., Иванова Р.Д., КалашниковаЕ.П. и Устинкина Т.И. Экстракорпоральное оплодотворение у человека споследующей имплантацией эмбриона и рождением ребенка. Арх. анатомии,гистологии и эмбриологии. – Л., 1987, Т.93, вып.10, с.39-43.3. Аншина М.Б., Здановский В.М. Если вам нужен ребенок. – М., 1998, 32с.4. Пшеничникова Т.Я. Бесплодие в браке. – М., 1991, 320с.5. Сметник В.П.. Тумилович Л.Г. Неоперативная гинекология. Руководстводля врачей. – М. 1999, с.476-480.
Рис. 5. Цикл развития доминантного фолликула Стимуляция суперовуляции в современных условиях основана на:§ стимуляции выделения собственных эндогенных гонадотропинов кломифеном;§ стимуляции экзогенными гонадотропинами (препараты из мочименопаузальных женщин - препараты человеческого менопаузального гонадотропина(чМГ), содержащие ЛГ и ФСГ (пергонал, неопергонал, хумегон) или ФСГ(метродин);§ стимуляции экзогенными гонадотропинами на фоне блокады собственныхгонадотропинов препаратами агонистов РГ ЛГ (декапептиды - трипторелин,бусерелин, госерелин, нафарелин и др.). Все эти препараты - синтетическиеаналоги гонадотропных рилизинг гормонов, и число их постоянно растет. Все онив 50 - 100 раз активнее эндогенных рилизингов. Действие их основано наблокаде собственных гонадотропинов, что позволило некоторым авторам называтьэтот метод «стимуляция суперовуляции на фоне гипофизэктомии», хотя на самомделе подавляется секреция только гонадотропинов, а не всех тропныхгипофизарных гормонов. На фоне снижения уровня собственных гонадотропиноввведение экзогенных гонадотропинов позволяет регулировать рост доминантныхфолликулов и созревание яйцеклеток.В повседневной практике используются так называемые «длинная схема» и«короткая схема» введения препаратов.При длинной схеме введение агонистов начинают в конце фолликулярной фазыпредыдущего цикла, под контролем снижения ЛГ в крови. После наступленияустойчивого низкого «плато» ЛГ приступают к введению гонадотропныхпрепаратов. При короткой схеме агонисты вводятся с 1-го дня менструальногоцикла, гонадотропины - с 3-го или 5-го дня цикла.При любом методе стимуляции суперовуляции постоянно контролируются числофолликулов, темпы их роста и величина фолликулов. До начала стимуляциисуперовуляции следует проводить предварительное гормональное обследование, ав период стимуляции - ультразвуковой (УЗ) и гормональный мониторинг. Какправило, исследуется уровень эстрадиола крови и толщина эндометрия.Критериями созревания яйцеклетки, точнее говоря, определением времени,оптимального для забора ооцитов, являются: концентрация эстрадиола не менее350 пг/мл на 1 фолликул диаметром более 15 мм, толщина эндометрия 0,8 - 1,0см.Механизм овуляции, в естественном спонтанном менструальном циклеобеспечивающийся выбросом эндогенного ЛГ, в циклах стимуляции суперовуляцииимитируется введением ЛГ-подобного препарата - хорионического гонадотропина(ХГ), получаемого из мочи беременных женщин.Через 35 - 36 ч после введения овуляторной дозы ХГ (10000 ед.) производитсятрансвагинальная пункция яичников (ТВП) в целях аспирации зрелых ооцитов.После их оплодотворения in vitro и инкубации в специальной питательной средечерез 48 - 72 ч, в зависимости от интенсивности дробления, производитсяперенос эмбрионов на ранней стадии дробления в полость матки пациентки.После пересадки эмбрионов рекомендуется вводить поддерживающие дозыхорионического гонадотропина по 1500 ед. и дексаметазона по 0,25 мг,последний подавляет иммунную реакцию отторжения плодного яйца. Препаратывводят до констатации беременности или до срока очередных менструаций (вслучае неудачи). ОСНОВНЫЕ ПРОБЛЕМЫ, ВОЗНИКАЮЩИЕ ПРИ ПРИМЕНЕНИИ ЭКО И ПЭ Программа ЭКО и ПЭ сложна в связи с тем, что она многоэтапная, но не всеэтапы можно объективно проконтролировать. Остановимся на некоторыхпроблемах, возникающих при применении этого метода.У женщины вовремя одного естественного менструального цикла можно получить всреднем не более одной яйцеклетки. Манипулируя с яйцеклеткой, ее легкопотерять или травмировать, поскольку ее размеры, включая corona radiata, непревышают 500 мк. Яйцеклетка может быть потеряна, например, в пипетке, вкапле питательной среды и т. п. Следовательно, необходим резерв клеток.В связи с этим возникла идея стимуляции так называемой суперовуляции, т. е.получения большего числа яйцеклеток (5 - 10 шт.) за счет примененияантагонистов эстрогенов и менопаузальных гонадотропинов ФСГ и ЛГ. Однакоувеличение количества яйцеклеток влечет за собой другой отрицательныйфактор - некоторые из них могут оказаться неполноценными, с нарушениемоогенеза или с хромосомной патологией, а другие могут стать на путь обратногоразвития в процессе фолликулогенеза. Так что не все полученные яйцеклеткимогут быть оплодотворены и нормально развиваться.Высокая частота самопроизвольных абортов (26,2%) после ЭКО являетсяотносительным показателем возможной патологии плодов. Эти данныеподтверждаются результатами исследования хромосом яйцеклеток и эмбрионовранних стадий развития. Известно, что от 35 до 50% нефертилизованных ооцитовв программе ЭКО имеют хромосомные аномалии. Выявлена высокая степеньзависимости хромосомных аномалий от возраста беременных женщин. Так,анэуплоидия диагностируется у 47% женщин после 35, лет и у 25% молодыхженщин; после кломифена - у 55%, после ЧМГ - у 23%, после чистого ФСГ - у22%. Значительно чаще хромосомная патология обнаруживается уфрагментированных эмбрионов (33%), чем у нормальных (20%).Анализ ооцитов и эмбрионов, полученных в программе ЭКО, свидетельствует отом, что основным фактором, обусловливающим высокую частоту хромосомныханомалий, является возраст беременных. Увеличение частоты хромосомнойпатологии с увеличением возраста имеет тенденцию, аналогичную таковой впопуляции, однако показатели этой патологии в 2 раза выше, чем популяционныеданные спонтанной фертильности. Высокая частота хромосомных аномалий внефертилизованных ооцитах свидетельствует о том, что множественная наведеннаястимуляцией овуляция, или суперовуляция, сопровождается высокой частотойхромосомной патологии ооцитов, которые созревают в аномальных условиях вотсутствие физиологической селекции и борьбы за существование доминирующегофолликула, который подавляет рост других фолликулов в одном пуле, возможно,не имеющих тенденции к нормальному развитию.Начато внедрение в практику методики флуорисцентной (in situ) гибридизации(FISH), обеспечивающей преимплантационную диагностику врожденной хромосомнойпатологии. Отдельные бластомеры извлекаются из эмбриона и проводится их FISH-анализ. Эмбрионы, по которым получено положительное заключение, могут бытьперенесены в полость матки для дальнейшего развития, а эмбрионы собнаруженной патологией не переносятся (в целях профилактики такихзаболеваний как гемофилия, синдром Патау, Дауна, Эдвардса, Клайнфельтера,моносомия Шершевского-Тернера).Достижением самых последних лет является генная терапия, применение которойвозможно и на самых ранних стадиях развития эмбрионов. При этом выполняетсяне только диагностика, но и лечение больных зародышей.Особенностью ЭКО является очень высокая частота многоплодных беременностей.Если при естественном зачатии рождается одна двойня на 70 - 80 родов, однатройня на 9000 родов и одна четверня на 50 000 родов, то после ЭКОмногоплодие, включая двойни, тройни и четверни, встречается примерно вполовине(!) всех беременностей. Хорошо известно, что многоплодие, особеннокогда беременность больше, чем двумя плодами, создает высокий риск осложненийи для матери, и для ребенка, как в процессе беременности, так и родов.Сегодня разработаны способы удаления (редукции) "лишних" плодов (больше двух)под ультразвуковым контролем. На самом деле лишние плоды не удаляют, а путемвведения специальных растворов добиваются того, что они перестают развиватьсяи постепенно рассасываются. Эта процедура производится на 7 - 8-й неделебеременности и, как правило, не сопровождается угрозой выкидыша остальныхплодов. Рассасывание лишних плодов может происходить и само по себе, безкаких-либо вмешательств, также до 7 - 8 нед.Имеются данные о возможности возникновения y человека таких «ошибокоплодотворения», как гино- и андрогенез.В программе ЭКО и ПЭ, к сожалению, присутствует возможность возникновенияряда грозных осложнений акушерско-гинекологического характера, которыесуществуют и в естественных условиях. Основное из них - внематочнаябеременность, которая может наступить, даже если маточные трубы у женщинынепроходимы, а также в случае, если они удалены недостаточно радикально(беременность наступает в культях труб). Вероятность наступления внематочнойбеременности в программе ЭКО и ПЭ 10,6%.Следует также знать, что нередко при лечении бесплодия методом ЭКО можетиметь место такое осложнение как синдром гиперстимуляции яичников (СГЯ).Синдром гиперстимуляции яичников (СГЯ) - комплекс патологических симптомов,возникающих на фоне применения стимуляторов овуляции, характеризующийсязначительным увеличением яичников, иногда разрывом их и кровотечением;наличием выпота в брюшной и плевральной полостях, возникновениемтромбоэмболий магистральных сосудов, многоплодной беременностью и пр.В последние годы, в связи с широким распространением лечения бесплодияметодом экстракорпорального оплодотворения, включающего как первый этапстимуляцию суперовуляции, СГЯ привлекает все большее внимание. Первыеописания СГЯ появились еще в 40-х годах, S. Ridberg сообщил о значительномувеличении яичников после применения гонадотропинов. В 1962 г. A. Southan,N. Ivanovsky опубликовали случаи СГЯ после приема значительных доз кломифена:в 1970 г. описаны случаи СГЯ при комбинированной терапии кломифеном игонадотропинами [Roland M.].Е. Raban и соавт. в 1967 г. предложили классификацию СГЯ, которой пользуютсядо сих пор все клиницисты:• легкая форма,• средней тяжести,• тяжелая.Данные о частоте СГЯ приводит Н. Li в 1993 г. в сборнике, посвященномусловиям репродуктивной медицины:— частота легкой формы достигает 23%,— средней тяжести - 10%,— тяжелой - 2%.J. Shenker, D. Weinstein расширили и детализировали классификацию, выделив вкаждой из трех форм еще две степени. Легкая форма:1-я степень - клиническая симптоматика отсутствует, содержаниеэстрадиола в плазме более 150 мкг, в моче прегнадиола выше 10 мг;2-я степень- к этим биохимическим изменениям присоединяется увеличение яичников до 5см в диаметре. Форма средней тяжести:3-я степень - боли, чувство тяжести внизу живота и изменения,описанные во 2-й степени;4-я степень - присоединяется тошнота, рвота, понос, размерыяичников - более 5 см в диаметре. Тяжелая форма:5-я степень - к описанным симптомам присоединяется асцит,гидроторакс, яичники более 12 см в диаметре;6-я степень - состояние крайне тяжелое, помимо асцита и гидротораксаразвивается гиперкоагуляция, уменьшается перфузия почек, осложняющаясяолигурией и почечной недостаточностью, яичники резко увеличены, отмечают ихразрывы и перекрут.Суммируя представленные данные, можно сказать, что, по-видимому, используемыев программах вспомогательной репродукции способы гормональной стимуляциифолликулогенеза и овуляции вносят свой вклад в увеличение числа такихошибок. Гибель зародышей в процессе имплантации может быть обусловленаперечисленными выше причинами, недостаточностью второй фазы цикла(изначально существовавшей или возникшей в процессе овариальной стимуляции),а также, возможно, особенностями становления иммунологических отношенийэмбриона с организмом матери, вследствие отсутствия трубного периодаразвития, в который эти отношения начинают активно устанавливаться («факторранней беременности» и т.п.).Трудно оценить влияние на гаметогенез и оплодотворение чисто внешних(экологических, антропогенных, социокультурных и т. п.) факторов. Однако они,безусловно, также вносят свой вклад в патологию раннего развития.Таким образом, в большинстве случаев пренатальные потери и приводящая к нимпатология у эмбрионов при использовании методов вспомогательной репродукциивозникают не необходимо и не случайно, а под влиянием определенных факторов,в том числе и приводящих к нарушению регулирующих репродуктивный процессмеханизмов. Элиминация же аномальных гамет, зигот и эмбрионов - процесс какнеобходимый, так и закономерный, направленный на сохранение постоянствагенотипа популяции. ЗАКЛЮЧЕНИЕ Проблема бесплодия возникла отнюдь не сегодня, она сопровождает человечествоеще с древних времен. Современная медицина достаточно глубоко изучила причинывозникновения женского и мужского бесплодия. Разработаны как лекарственные,т.е. консервативные, методы терапии бесплодия, так и оперативные.Однако неудовлетворенность достигнутыми результатами привела к разработкенового метода лечения бесплодия - ЭКО и ПЭ, который быстро завоевал позициюлидирующего в этом направлении.В данной работе представлены основные проблемы программы ЭКО и ПЭ и возможныеосложнения, возникающие на различных ее этапах.Хотя применение метода ЭКО и ПЭ не позволяет в целом решить возникшую встране критическую демографическую ситуацию, тем не менее широкое внедрениеего в практику здравоохранения поможет избавиться от бесплодия сотням тысячсупружеских пар, а следовательно, осуществить также их психологическуюреабилитацию.В заключение необходимо отметить, что благодаря успехам программы ЭКОдостигнуты положительные результаты в фундаментальных исследованияхчеловеческих гамет и эмбрионов. ЛИТЕРАТУРА 1. Экстракорпоральное оплодотворение и его новые направления в леченииженского бесплодия (теоретические и практические подходы): Руководство дляврачей / Под. ред. В.И.Кулакова, Б.В.Леонова – М., 2001, 782 с.2. Никитин А.И., Китаев Э.М., Савицкий Г.А., Иванова Р.Д., КалашниковаЕ.П. и Устинкина Т.И. Экстракорпоральное оплодотворение у человека споследующей имплантацией эмбриона и рождением ребенка. Арх. анатомии,гистологии и эмбриологии. – Л., 1987, Т.93, вып.10, с.39-43.3. Аншина М.Б., Здановский В.М. Если вам нужен ребенок. – М., 1998, 32с.4. Пшеничникова Т.Я. Бесплодие в браке. – М., 1991, 320с.5. Сметник В.П.. Тумилович Л.Г. Неоперативная гинекология. Руководстводля врачей. – М. 1999, с.476-480.
Дата добавления: 2015-08-08; просмотров: 1013;
