Фактор эквивалентности. Эквивалентные массы и эквивалентные объемы.
Безразмерная величина, показывающая, какая часть моля элемента или вещества Х эквивалентна 1 моль атомарного водорода(одному иону водорода.) называется фактором эквивалентности fэ (Х):
3.1Фактор эквивалентности химического элемента Х в его соединениях равен:
fэ (Х) = 1:|с.о.| ,
где с.о. – степень окисления элемента Х в данном соединении.
Масса одного эквивалента (эквивалентная масса) Мэ(Х), г/моль,определяется по формуле:
Мэ(Х) = fэ (Х)·М(Х). (1.1)
Если в реакции участвуют газы, то могут быть найдены их эквивалентные объемы Vэ, л/моль (при н.у.) по формуле:
Vэ(Х) = fэ (Х)·22,4л . (1.2)
Пример 1.Найти величины факторов эквивалентности и эквивалентных масс для азота в следующих веществах: NН3, НNО3, NО2.
Решение.Для определения фактора эквивалентности химического элемента необходимо определить его степень окисления. Степень окисления – это условный заряд атома элемента в молекуле, рассчитанный исходя из ее электронейтральности и на основе предположения, что молекула состоит из ионов. Водород и кислород в большинстве сложных веществ имеют постоянные степени окисления: водород - +1, кислород -2; но есть исключения. В гидридах активных металлов степень окисления водорода равна -1(NаН-1), в пероксидах водорода и металлов степень окисления кислорода равна -1(Н2О2 -1), во фториде кислорода - +2(О+2F2).
Тогда степень окисления азота в NН3 равна -3, fэ (N) = 1:3,
Мэ(N) =14:3=4,67 г/моль.
Соответственно, для НNО3 степень окисления азота равна +5, fэ (N) = 1:5, Мэ(N) =14:5=2,8 г/моль.
В NО2 степень окисления азота равна +4, fэ (N) = 1:4, Мэ(N) =14:4=3,6 г/моль.
3.2.Фактор эквивалентности вещества Х, участвующего в окислительно-восстановительном процессе, равен:
fэ (Х) = 1: Nе, (1.3)
где Nе – количество электронов, которые теряет или присоединяет одна молекула вещества Х.
Пример 2.Найти величину фактора эквивалентности, эквивалентные массу и объем для сероводорода Н2S, взаимодействующего с кислородом с образованием диоксида серы SO2 и паров воды.
Решение.В данном химическом процессе степень окисления серы изменяется от -2 (Н2S) до +4 (SO2). Следовательно, молекула Н2S теряет 6 электронов, т.е. fэ (Н2S) = 1:6; Мэ(Н2S) = 34:6 = 5,66г/моль; Vэ(Н2S) = 22,4:6 = 3,73л/моль.
3.3.Фактор эквивалентности вещества Х, участвующего в ионообменном процессе, равен:
fэ (Х) = 1: (Ni·|zi|), (1.4)
где Ni и zi - соответственно число и заряд ионов, которыми обменивается молекула реагирующего вещества со своим партнером.
Пример 3.В нижеприведенных схемах реакций определите факторы эквивалентности исходных веществ:
а) LiOH + H3PO4 →Li2HPO4 + H2O
Молекула LiOH теряет в данной реакции один однозарядный ион ОН- , поэтому fэ (LiOH) = 1: (1·|-1|) = 1;молекула H3PO4 обменивается двумя однозарядными ионами Н+ , поэтому fэ (H3PO4) = 1: (2·|+1|) = 1:2.
Пример 4.Выразить эквивалентную массу оксида, гидроксида, сульфата и хлорида металла.
Решение.Эквивалентная массавещества в общем случае определяется по формуле (1.1). В частном случае ее можно представить как сумму эквивалентных масс составных частей молекулы или кристалла вещества.
1) Эквивалентная масса оксида равна сумме эквивалентных масс элемента и кислорода:
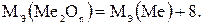 (1.5)
(1.5)
2) В состав гидроксида входят атомы металла и гидроксильные группы:
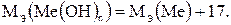 (1.6)
(1.6)
3) В молекулу сульфата металла входят ионы данного металла и сульфатные группы (SO4)2-:
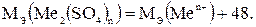 (1.7)
(1.7)
4) Эквивалентную массу хлорида металла определяют по аналогии с предыдущими случаями:
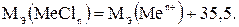 (1.8)
(1.8)
4. Закон эквивалентов:количества эквивалентов всех участвующих в реакции веществ равны между собой.
Следствие из закона эквивалентов.Массы (объемы) реагирующих друг с другом или образующихся в результате реакции веществ пропорциональны их эквивалентным массам Мэ (эквивалентным объемам для газов Vэ).
m1: Мэ1 = m2: Мэ2 = V1: Vэ1= V2: Vэ2.
Дата добавления: 2015-08-08; просмотров: 3807;
