Основные количественные законы химии
Федеральное агентство по образованию
Государственное образовательное учреждение
высшего профессионального образования
«ЮЖНО-РОССИЙСКИЙ ГОСУДАРСТВЕННЫЙ
ТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ
(НОВОЧЕРКАССКИЙ ПОЛИТЕХНИЧЕСКИЙ ИНСТИТУТ)»
ВОЛГОДОНСКИЙ ИНСТИТУТ
Лекции
по курсу «Общая ХИМИЯ»
для всех специальностей
(34 часа лекций)
Волгодонск 2007 г.
Лекция 1.Введение.
Основные понятия и количественные законы химии. Фактор эквивалентности. Его нахождение для реакций ионного обмена и окислительно-восстановительных процессов. Вычисление эквивалентных масс и эквивалентных объемов. Закон эквивалентов. Его применение.
Основные понятия химии..
Химия – наука о веществах и законах, по которым происходят превращения одних веществ в другие. Вещество и поле - две формы существования материи. Вещество – форма материи, которая обладает собственной массой, т.е. массой покоя. Состоит из элементарных частиц: электронов, протонов, нейтронов, мезонов и др.Химия изучает главным образом вещество, организованное в атомы, молекулы, ионы и радикалы. Поле – форма существования материи, которая тесно связана с энергией. Важнейший закон природы - закон сохранения массы и энергии был сформулирован в 1760 г. М.В. Ломоносовым. Современная формулировка: в изолированной системе сумма масс и энергий постоянна. Изолированной системой является та система, у которой нет обмена с окружающей средой ни массой, ни энергией. Между массой и энергией существует взаимосвязь согласно уравнению Е = mc2. Объект изучения химии – элементы и их соединения. Элемент – определенный вид атомов, обладающих определёнными зарядами ядер. Атом – мельчайшая частица элемента, сохраняющая все его химические свойства. Атомы складываются в молекулы.
Молекулой называется наименьшая частица вещества, которая может существовать самостоятельно, обладает химическими свойствами данного вещества и состоит из атомов одного или нескольких элементов. Молекулы, состоящие из атомов одного элемента, образуют простые вещества (Cu, H2, O3). Простые вещества образованы атомами одного химического элемента и потому являются формой его существования в свободном состоянии, например, сера, железо, озон, алмаз. Сложные вещества образованы разными элементами и могут иметь состав, постоянный или меняющийся в разных пределах. Молекулы, состоящие из атомов различных элементов, образуют сложные вещества ( HCl, Н2O, C17H35, COOH ) Химические свойства вещества характеризуют их способность участвовать в химических реакциях, т.е. превращениях одних веществ в другие. Для понимания этих свойств необходимо знать не только состав, но и строение веществ.
Например:
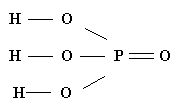
| ||
| Н3РО4 | ||
В химии существует очень важное понятие - количество вещества. Количество вещества – число структур единиц молекул, атомов. ионов и т. д. в системе. Единицей количества вещества является моль.
Моль – это количество вещества системы, равное 6,022.1023 структурных единиц данного вещества. Количество структурных единиц равно количеству атомов, содержащихся в 0,012 кг 6C12. При использовании термина "моль" следует указывать частицы (моль молекул, атомов...). Масса одного моль вещества называется молярной массой, размерность: кг/моль или г/моль. Объем одного моль вещества называется молярным объемом, размерность: м3/моль или л/моль. При нормальных условиях (273,15 К(0°С); 1,0133·105Па (760 мм рт.ст.). 1 моль различных газов занимает объем 22,4 л.
Основные количественные законы химии
1) Закон постоянства состава. Химически чистые вещества имеют один и тот же количественный состав независимо от того, каким способом они получены.
2) Закон кратных отношений.Если два элемента образуют между собой несколько различных соединений, то на одну и ту же массу одного из них приходятся такие массы другого, которые относятся между собой как простые целые числа.
Например, массовые соотношения С:О в CO и CO2 равны 12:16 и 12:32. Следовательно, массовые соотношения углерода, связанные с постоянной массой кислорода в CO2 и CO, равно 2:1.
3) Закон эквивалентов. Все вещества реагируют между собой в эквивалентных количествах.
Эквивалент – реальная или условная частица вещества, которая может замещать, присоединять или быть каким-либо другим способом эквивалентной одному иону водорода.
Дата добавления: 2015-08-08; просмотров: 2447;
