Наименьшее возможное значение энергии осциллятора равное называется нулевой энергией.
Существование нулевой энергии у квантового осциллятора вытекает из принципа неопределенности.
Согласно классической теории полная энергия осциллятора равна:
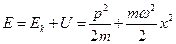 .
.
Поскольку у квантового осциллятора импульс и координата не могут одновременно определенные значения, то и равны нулю одновременно они не могут быть.
Существование нулевой энергии подтверждается экспериментами по изучению рассеяния света на кристаллах при низких температурах. Оказалось, что интенсивность рассеянного света по мере понижения температуры стремится не к нулю, а к некоторому конечному значению, что указывает на то, что при абсолютном нуле колебания атомов в кристаллической решетке не прекращаются.
Квантовая механика позволяет вычислить вероятность переходов квантовой системы из одного состояния в другое. Подобные вычисления для квантового осциллятора показали, что для него возможны переходы только между соседними уровнями, отстоящими друг от друга на 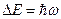 .
.
При таких переходах квантовое число n меняется на единицу, 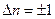 .
.
Условия, накладываемые на изменение квантовых чисел при переходах из одного состояния в другое, называются правилами отбора.
Таким образом, квантовая механика достаточно строго доказала, что атомы (а именно они являются квантовыми осцилляторами) излучают энергию порциями, величина которых равна 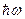 . Этот результат Планк в своё время вынужден был постулировать, чтобы объяснить тепловое излучение.
. Этот результат Планк в своё время вынужден был постулировать, чтобы объяснить тепловое излучение.
ЛЕКЦИЯ 5
АТОМНАЯ ФИЗИКА
1. Опыты Резерфорда. Постулаты Бора.
2. Опыт Франка и Герца.
3. Атом водорода по Бору.
4. Спектр излучения атома водорода.
 Первая модель атома была предложена в 1903 году английским физиком Дж. Дж. Томсоном. По его модели атом представляет собой плотное образование, подобное булке с изюмом. Основной объём атома представлял, по Томсону, шар, равномерно заполненный положительным электрическим зарядом (тесто в булке), внутри которого по определенным законам симметрии располагались микрообразования - электроны (изюминки). Общий заряд атома складывался из положительного заряда основного объёма и суммарного отрицательного заряда всех электронов, так, что атом в целом оказывался электронейтрален. Модель имела целый ряд необъяснимых допущений, что и определило её несостоятельность. Основные претензии к модели можно сформулировать следующим образом:
Первая модель атома была предложена в 1903 году английским физиком Дж. Дж. Томсоном. По его модели атом представляет собой плотное образование, подобное булке с изюмом. Основной объём атома представлял, по Томсону, шар, равномерно заполненный положительным электрическим зарядом (тесто в булке), внутри которого по определенным законам симметрии располагались микрообразования - электроны (изюминки). Общий заряд атома складывался из положительного заряда основного объёма и суммарного отрицательного заряда всех электронов, так, что атом в целом оказывался электронейтрален. Модель имела целый ряд необъяснимых допущений, что и определило её несостоятельность. Основные претензии к модели можно сформулировать следующим образом:
- почему положительный заряд, заполняющий основной объём, не разлетается под действием кулоновских сил отталкивания;
- почему отрицательный и положительный заряды существуют в разных формах, хотя природа у них одна;
- непонятен механизм излучения и поглощения атомом энергии.
В 1911 году Резерфорд опубликовал результаты, полученные им и его сотрудниками по изучению рассеяния альфа-частиц ( 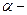 частиц имеет положительный заряд) при прохождении их через очень тонкие фольги.
частиц имеет положительный заряд) при прохождении их через очень тонкие фольги.
Рис.19.Схема опыта Резерфорда.
Узкий пучок 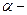 частиц, испускаемых радиоактивным веществом, падал на тонкую фольгу. Направление движения рассеянных частиц (угол
частиц, испускаемых радиоактивным веществом, падал на тонкую фольгу. Направление движения рассеянных частиц (угол  ) и их количество после фольги фиксировалось визуально по вспышкам (сцинтилляциям) на круговом экране, покрытым флюоресцирующим веществом.
) и их количество после фольги фиксировалось визуально по вспышкам (сцинтилляциям) на круговом экране, покрытым флюоресцирующим веществом.
Оказалось, что:
1. основная масса частиц проходит через фольгу, не отклоняясь;
2. некоторое количество частиц отклоняется от первоначального направления на различные углы, вплоть до 180 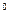 .
.
На основании полученных результатов Резерфорд предложил новую модель атома.
По Резерфорду атом представляет собой динамическую систему электрических зарядов сферической формы.
-В центре атома находится микроскопическое образование 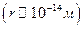 , которое он назвал ядром, имеющее высокую плотность и заряженное положительно. Именно оно и обеспечивало отклонение
, которое он назвал ядром, имеющее высокую плотность и заряженное положительно. Именно оно и обеспечивало отклонение  частиц на значительные углы при столкновении с ним.
частиц на значительные углы при столкновении с ним.
-Вокруг ядра по круговым траекториям вращаются электроны. При построении своей модели Резерфорд предполагал, что взаимодействие между ядром и электронам определяется законом Кулона.
Количественная проверка, проведенная сотрудниками Резерфорда, дала очень хорошее совпадение теоретических и экспериментальных результатов.
Однако представленная Резерфордом модель противоречила законам классической механики и электродинамики.
1. Если электроны вращаются вокруг ядра по круговым траекториям, то они, согласно Максвеллу, должны изучать электромагнитные волны, теряя при этом энергию. В результате электроны должны упасть на ядро, т.е. атом должен перестать существовать.
Этого в природе не наблюдается, атом является очень устойчивой структурой.
2. К моменту появления модели Резерфорда было известно, что одиночные атомы дают линейный спектр излучения. По модели спектр излучения должен быть непрерывным или хотя бы полосатым.
Все это говорило о том, что при построении модели не были учтены особенности поведения и взаимодействия микрочастиц не известные к тому моменту.
Для устранения возникших противоречия ученик Резерфорда Нильс Бор сформулировал два квантовых постулата, которые не укладывались в рамки классической физики, и условие квантования электронных орбит.
1. Из бесконечного множества возможных орбит осуществляются лишь те, которые удовлетворяют определенным условиям. На этих орбитах электрон не излучает и не поглощает энергию. Эти орбиты называются стационарными.
2. При переходе с одной стационарной орбиты на другую электрон поглощает или испускает квант энергии 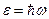 , равный разности энергий разрешенных орбит
, равный разности энергий разрешенных орбит
Дата добавления: 2015-08-08; просмотров: 824;
