Строение вещества .
2.18. Вещество называется элементом, если оно характеризуется однородными химическими свойствами. Вещество состоит из атомов и молекул.
Замечание:
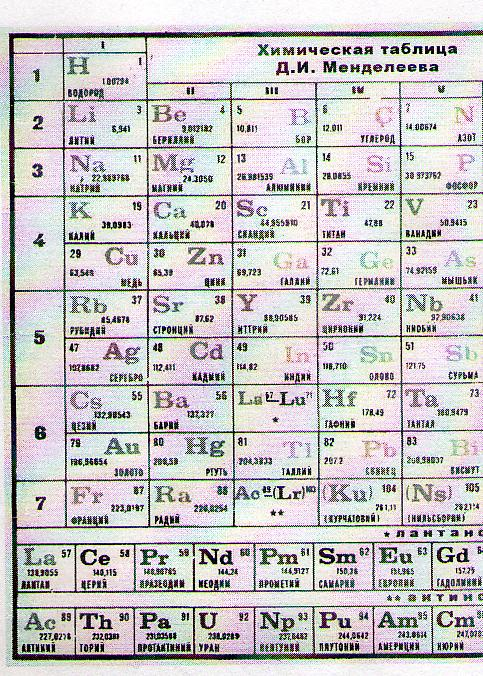
1) в таблицу Менделеева занесены элементы;
в природе 92 стабильных элемента, химических элемента,
2) любое вещество состоит из элементов.
2.19. Простое вещество – вещество, молекулы которого состоят из атомов одного химического элемента. Графит, алмаз, фуллерен состоят из углерода.
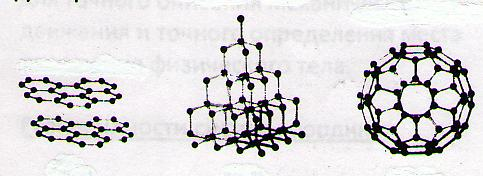
графит алмаз фуллерен(углерод) ( углерод ) (углерод )
Замечание: физические свойства вещества зависят порядка расположения атомов.
2.20. Сложное вещество – вещество, молекулы которого состоят из атомов разных элементов.
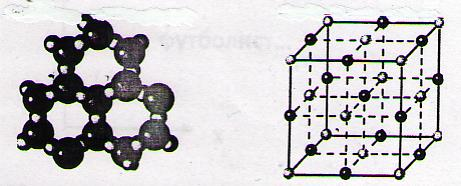
Лёд соль
(водород, кислород) (натрий, хлор)
2.21. Вещества, встречающиеся в космосе:
« 99 % веществ … состоят из атомов водорода и гелия».
« …на 10 000 атомов водорода приходится 500 атомов гелия и только один атом других элементов».
Атомы, и элементарные частицы
1.22. Атом– мельчайшая частица элемента, характеризующая химические свойства этого элемента. В природе 92 стабильных( постоянных)элемента.
1) Атом состоит изэлементарных частиц: протонов, нейтронов, электронов.
2) Ядро атома –центральная часть атома, состоящая из протонов и нейтронов.
Почти вся масса атома в ядре.
3) электронная оболочка атома –электроны, элементарные частицы, совершающие движения по круговым орбитам, вокруг ядра.
Внейтральном атоме число протонов равно числу электронов.
2.23. Примеры устройства атомов:
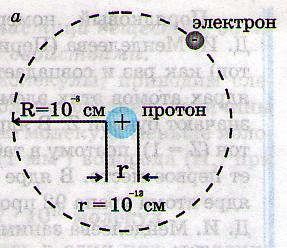
1. Самый легкий элемент водорода (Н)содержит один протон и один электрон(N1 в табл. Менделеева).
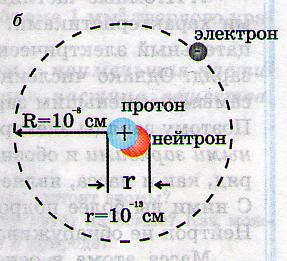
2. Тяжёлый элемент водорода дейтерий (D)содержит один протон, один нейтрон, один электрон ( N1 в табл. Менделеева).
Замечание: число протонов в ядре определяет порядковый номер элемента в таблице Менделеева.
3. Атом углерода (С)содержит шесть протонов, шесть нейтронов, шестьэлектронов, вращающихся по двум разным орбитам

4. Атом серы состоит из16 протонов, 16 нейтронов и 16 электронов, которые вращаются по трём разным орбитам.

5. Атом урана состоит из92 протонов, 92 электронов.
6. Формула вычисления количества нейтронов в атоме:
N = А ‒ Z
∙N – число нейтронов,
∙ А – массовое число (см. в табл. Менделеева внизу клетки).
∙ Z – число протонов ( Z= порядковому номеру элемента в таблице Менделеева, вверху клетки).
∙ Внейтральном атоме число протонов равно числу электронов.
∙ Электрический заряд электрона и протона одинаковый, наименьший в природе, т.е. элементарный.
∙ Заряд электрона(-е),
∙ Заряд протона(+е)
∙ Заряд нейтрона = 0.
1)Количество нейтронов у урана, нептуния, полония, ртути:
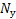 = А-Ζ = 235‒92 = 143
= А-Ζ = 235‒92 = 143
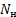 = А-Ζ = 237-93 = 144
= А-Ζ = 237-93 = 144
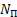 = А-Ζ = 209-84 = 125
= А-Ζ = 209-84 = 125
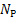 = А-Ζ = 201-80 = 121
= А-Ζ = 201-80 = 121
Замечание: физические и химические свойства элементов зависят от количества протонов в ядре атома.
2.24. «Огромное» свободное пространство внутри атома.
Ядра атома 
вишня (в центр стадиона) 
границы стадиона – орбиты электронов.

Вывод: в атоме большее место
занимает
пустота
2.25. Элементарные частицы – частицы, из которых состоят атомы – это протоны, электроны, нейтроны.
2.26. Протон ‒ элементарная частица обладающая элементарным положительным зарядом в природе, (+e) – обозначение заряда. Масса протона 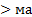 ссы электрона ≈ в 1836 раз. Заряд протона по модулю равен заряду электрона.
ссы электрона ≈ в 1836 раз. Заряд протона по модулю равен заряду электрона.
2.27. Электрон ‒элементарная частица, обладающая элементарным зарядом в природе, (‒e) ‒ обозначение заряда. Масса электрона < массы протона ≈ в 1836 раз. Заряду электрона по модулю равен заряду протона.
2.28. Нейтрон –элементарная частица нейтральная, т.е. не обладающая зарядом. Масса нейтрона > массы электрона ≈ в 1841 раз.
Дата добавления: 2015-07-10; просмотров: 1338;
