Принцип Паули. Периодическая система элементов.
Энергия каждого электрона в атоме характеризуется четырьмя квантовыми числами:
– главным 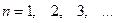 ;
;
– орбитальным 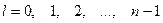 ;
;
– магнитным 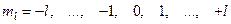 ;
;
– спиновым 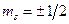 .
.
По мере увеличения порядкового номера атома происходит последовательное строго определенное заполнение электронных уровней атома. Порядок заполнения объясняется принципом Паули.
Принцип: в любом квантовом состоянии может находиться не более одного электрона (другими словами, в атоме или любой другой квантовой системе не может быть электронов с одинаковыми значениями всех четырех квантовых чисел).
Поэтому каждый следующий электрон невозбужденного атома должен занимать самый глубокий (с наименьшей возможной энергией) из еще незаполненных уровней.
Данному значению 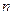 соответствует
соответствует 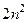 состояний, отличающихся друг от друга значениями квантовых чисел
состояний, отличающихся друг от друга значениями квантовых чисел 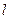 ,
, 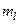 ,
, 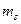 . Совокупность электронов атома с одинаковыми значениями числа
. Совокупность электронов атома с одинаковыми значениями числа 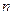 образуют оболочку, обозначаемую большими буквами латинского алфавита:
образуют оболочку, обозначаемую большими буквами латинского алфавита:
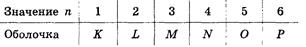
Оболочки подразделяют на подоболочки, отличающиеся числом 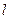 . Число состояний в подоболочке равно
. Число состояний в подоболочке равно 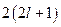 . Подоболочки обозначают или большими латинскими буквами с числовым индексом (
. Подоболочки обозначают или большими латинскими буквами с числовым индексом ( 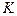 ,
, 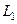 ,
, 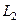 ) или в виде:
) или в виде: 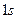 ,
, 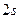 и т. д., где цифра означает главное квантовое число, т. е. принадлежность к соответствующей оболочке.
и т. д., где цифра означает главное квантовое число, т. е. принадлежность к соответствующей оболочке.
Замечание: некоторые авторы оболочки называют слоями, а подоболочки – оболочками (будьте внимательны с терминологией).
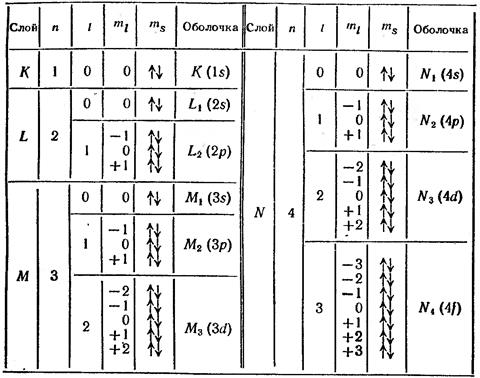
В таблице  обозначены значения спинового числа
обозначены значения спинового числа 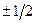 .
.
Для полностью заполненных оболочки и подоболочки суммарный орбитальный и суммарный спиновый моменты равны нулю, а, следовательно, и суммарный полный момент равен нулю.
Принцип Паули дает объяснение периодической повторяемости свойств атомов, отображенной в периодической системе элементов Менделеева. Каждый следующий атом получается из предыдущего добавлением заряда ядра на единицу и добавлением одного электрона, который помещают в разрешенное принципом Паули состояние с наименьшей энергией.
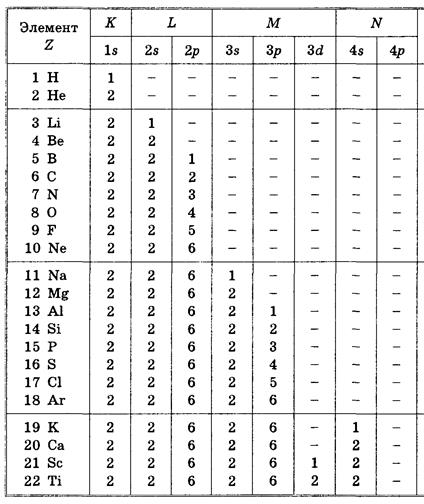
Примеры записи электронных конфигураций атомов:
водород 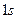
гелий 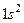
литий 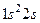
натрий 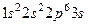
Дата добавления: 2015-08-08; просмотров: 2038;
