Спектры излучения и поглощения атома водорода.
АТОМНАЯ ФИЗИКА
Модель атома водорода по Бору.
Спектры излучения и поглощения атома водорода.
Постулаты Бора:
1. Атом может находиться только в особых (квантовых) стационарных состояниях, каждому из которых соответствует определенная энергия 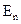 . В стационарном состоянии атом не излучает.
. В стационарном состоянии атом не излучает.
2. При переходе атома из стационарного состояния с большей энергией 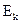 в стационарное состояние с меньшей энергией
в стационарное состояние с меньшей энергией 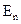 происходит излучение света с частотой
происходит излучение света с частотой 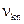 :
: 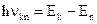 , где h – постоянная Планка. Наоборот, при переходе атома из состояния с меньшей энергией
, где h – постоянная Планка. Наоборот, при переходе атома из состояния с меньшей энергией 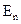 в состояние с большей энергией
в состояние с большей энергией 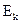 атом поглощает квант света с частотой
атом поглощает квант света с частотой 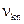 .
.
Согласно Бору атом имеет планетарную модель. Вокруг положительно заряженного ядра вращаются электроны по стационарным орбитам, называемых боровскими. При переходе электрона с одной стационарной орбиты на другую атом или поглощает, или излучает квант света.
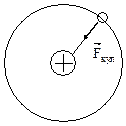
| Рассмотрим движение электрона по боровской орбите в атоме водорода. Ядро водорода имеет положительный заряд, равный по модулю заряду электрона. |
Исходя из второго закона Ньютона, запишем
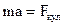 ,
,
где a – центростремительное ускорение движения электрона по орбите.
Иначе этого уравнение можно представить
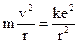 , (1)
, (1)
где r – расстояние между ядром атома и движущимся электроном (радиус орбиты); 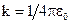 – коэффициент пропорциональности в законе Кулона (в СИ); e – элементарный заряд (модуль заряда электрона и ядра атома водорода).
– коэффициент пропорциональности в законе Кулона (в СИ); e – элементарный заряд (модуль заряда электрона и ядра атома водорода).
Помимо приведенного уравнения классической физики Бор ввел квантовое уравнение, учитывающее квантование момента импульса электрона на боровской орбите:
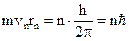 , (2)
, (2)
где 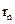 и
и 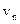 – радиус n-ой боровской орбиты электрона и скорость электрона на этой орбите; n = 1, 2, 3… (любое целое число).
– радиус n-ой боровской орбиты электрона и скорость электрона на этой орбите; n = 1, 2, 3… (любое целое число).
При решении системы уравнений (1) и (2) получим
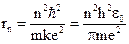 .
.
Радиус первой боровской орбиты составляет 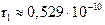 м.
м.
Определим энергию электрона в атоме водорода. Кинетическая энергия электрона на n-ой орбите равна
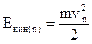 ,
,
или, используя уравнение (1)
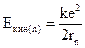 .
.
Потенциальная энергия электрона (энергия кулоновского взаимодействия электрона с положительно заряженным ядром) равна
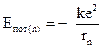 .
.
Тогда полная энергия электрона
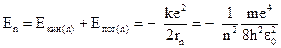 . (3)
. (3)
Электрон, находясь в атоме, обладает только отрицательной энергией! Число n, определяющее значение энергии электрона и состояние атома, называют главным квантовым числом. Основное состояние атома соответствует n = 1. При n > 1 атом находится в возбужденном состоянии.
Построенная Бором модель атома позволила объяснить экспериментально обнаруженные спектры излучения атомов водорода и водородоподобных ионов (He+, Li+2, т.е. ионизированные атомы, имеющие один электрон). Схема спектров имеет вид (см. рис.).
Слева обозначены уровни энергии электрона, а справа соответствующие им главные квантовые числа. Расстояния между уровнями при возрастании n уменьшаются (становится меньше разность между соседними значениями энергии электрона в атоме). При 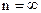 электрон становится свободным, т.е. покидает пределы атома, и энергия электрона
электрон становится свободным, т.е. покидает пределы атома, и энергия электрона 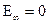 . На первом уровне
. На первом уровне 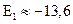 эВ.
эВ.
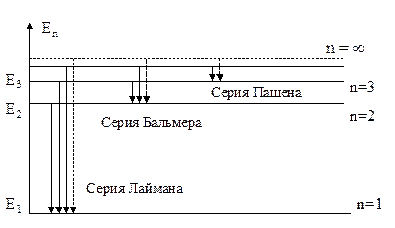
Стрелками указаны возможные переходы электрона с уровня с большей энергией на уровень с меньшей энергией при испускании атомом кванта света. Частота излучаемого кванта определяется из выражения
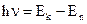 при k > n,
при k > n,
а для длины волны можно записать
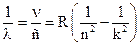 ,
, 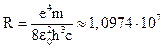 м–1
м–1
В последнем уравнении с – скорость света в вакууме; R – постоянная Ридберга. Формула для R получена, исходя из уравнения (3).
Полученная формула для длин волн описывает наблюдаемые спектры излучения. Например, при значении n = 1 возможные длины волн излучения определяются следующим образом
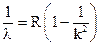 , где k = 2, 3, 4,…
, где k = 2, 3, 4,…
Данный спектр получил название серии Лаймана.
Следующий набор длин волн (частот), соответствующий значению n = 2, называется серией Бальмера:
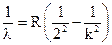 , где k = 3, 4, 5, …
, где k = 3, 4, 5, …
Примечание:
Построить количественную теорию атома гелия и более сложных атомов на основе боровских (полуклассических) представлений не удалось. Рассмотрение современной теории строения сложных атомов выходит за рамки настоящего курса физики.
Дата добавления: 2015-08-08; просмотров: 3055;
