Растворимость
Способность одного вещества растворяться в другом при заданных условиях имеет количественное выражение, называемое растворимостью. Растворимость данного вещества равна его концентрации в насыщенном растворе при данной температуре. Часто растворимость дается как масса растворенного вещества в насыщенном растворе, приходящаяся на 100 г массы растворителя, или как молярная концентрация растворенного вещества в насыщенном растворе (в этом случае растворимость обозначается S, выражается в моль/л).
Насыщенным раствором называется такой раствор, который находится в динамическом равновесии с избытком растворяемого вещества. Понятие «насыщенный раствор» связано с обратимостью процесса растворения. На границе раздела фаз растворяемое вещество – раствор одновременно идут два процесса: растворение и выделение вещества из раствора. Если скорости этих процессов равны, то система находится в состоянии динамического равновесия (Vр-ния=Vкрист), отвечающего насыщению раствора.
Если концентрация вещества в растворе при заданных условиях меньше его растворимости, то раствор является ненасыщенным. Скорость растворения при контакте вещества с растворителем больше скорости выделения вещества из раствора (Vр-ния>Vкрист).
При определенных условиях можно получить раствор, концентрация вещества в котором больше растворимости (осторожное и медленное охлаждение насыщенных при высокой температуре растворов). Такой раствор называют пересыщенным. Контакт раствора с веществом вызывает выделение вещества из раствора (Vр-ния<Vкрист). Концентрация пересыщенного раствора падает до тех пор, пока не становится равной растворимости вещества при данных условиях. Пересыщенные растворы весьма неустойчивы. Простое сотрясение сосуда или введение в раствор кристаллика соли вызывает выпадение в осадок избытка растворенного вещества.
Растворимость различных веществ в воде изменяется в широких пределах. Если в 100 г воды растворяется более 10 г вещества, то такое вещество принято называть хорошо растворимым. Если растворяется менее 1 г вещества – малорастворимым, и наконец, - практически нерастворимым, если в раствор переходит менее 0,01 г вещества.
Однако абсолютно нерастворимых веществ нет. Если опустить в воду стеклянную палочку или проволочку из золота или серебра, то они в ничтожно малых количествах все же растворяются в воде. Как известно, растворы серебра или золота в воде убивают микробов. Стекло, серебро, золото - практически нерастворимые в воде вещества.
Растворимость зависит от:
- природы растворенного вещества и растворителя;
- внешних условий (температуры; давления для газообразных веществ).
Влияние на растворимость природы компонентов.При получении растворов часто выполняется эмпирическое правило: подобное растворяется в подобном (полярное – в полярном, неполярное – в неполярном). Т.е. полярные и ионные вещества хорошо растворимы в полярных растворителях (например, поваренная соль NaCl, в которой реализуется ионная связь хорошо растворяется в воде, молекулы которой полярны). Неполярные вещества хорошо растворимы в неполярных растворителях (пример: керосин растворяется в растительном масле).
Влияние на растворимость внешних условий. Поскольку растворимость характеризует истинное равновесие, для определения влияния температуры и давления на растворимость можно воспользоваться принципом Ле Шателье: характер действия Т и Р будет определятся соответственно знаком DHр и DVр, а его величина – их абсолютным значением.
Чаще всего растворимость твердых веществ при повышении температуры увеличивается (DHр>0), а жидких и газообразных – уменьшается (DHр<0).
Так как при растворении газообразных веществ в жидкости DV<0, то повышение давления, согласно принципу Ле Шателье, способствует росту растворимости газов. Эта зависимость растворимости от давления для малорастворимых веществ (газов) выражается законом Генри: растворимость газа прямо пропорциональна его парциальному давлению над раствором ( 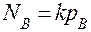 , где NВ - молярная (мольная) доля газа В в растворе; pВ - парциальное давление данного газа над раствором; k - константа Генри, справочная величина).
, где NВ - молярная (мольная) доля газа В в растворе; pВ - парциальное давление данного газа над раствором; k - константа Генри, справочная величина).
Дата добавления: 2015-08-08; просмотров: 1783;
