Зависимость скорости химической реакции от температуры
Зависимость скорости химической реакции от температурыопределяется правилом Вант-Гоффа и уравнением Аррениуса.
Правило Вант-Гоффа:при увеличении температуры на каждые 100 скорость химической реакции возрастает в 2-4 раза.
Математически это запишется следующим образом:
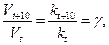 (7)
(7)
где: Vt и kt – скорость и константа скорости химической реакции при температуре t; Vt+10 и kt+10 – скорость и константа скорости химической реакции при температуре t+10; g – температурный коэффициент скорости химической реакции; для большинства реакций значения g = 2 ÷ 4.
В общем случае, когда температура процесса изменилась на Dt, уравнение (7) можно преобразовать к виду
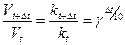 . (8)
. (8)
Уравнение Аррениуса.Уравнения (7) и (8) лишь приближенно оценивают зависимости V = f(t) и k = f(t). Функциональная зависимость константы скорости химической реакции (скорости химической реакции) от температуры была установлена шведским ученым Св. Аррениусом (1889 г.). Она выражается уравнением, названным в его честь уравнением Аррениуса:
k = A e-Ea/RT, (9)
где: А – предэкспоненциальный множитель; ЕА – энергия активации химической реакции.
А и ЕА являются важными характеристиками каждой химической реакции. Выясним физический смысл этих величин.
Предэкспоненциальный множитель
А = р·z, (10)
где z – число соударений молекул реагирующих веществ в единице объема за единицу времени; р – стерический (вероятностный) фактор, учитывает влияние пространственной ориентации молекул на скорость реакции (или константу скорости). Значения р = 10-9 ÷1. Малые значения р отвечают реакциям между сложными по своей структуре органическими соединениями.
Энергия активации химической реакции.Не все сталкивающиеся молекулы взаимодействуют с образованием продуктов реакции, а только те активные молекулы, которые обладают достаточной энергией, чтобы разорвать или ослабить связи в исходных молекулах, создав возможность образования новых молекул.
Например, при химическом взаимодействии: H2 + I2 = 2HI должны разорваться связи Н-Н и I-I и образоваться связи Н- I. В некоторый момент времени возникает переходное состояние, когда одни связи не полностью разорвались, а другие уже начали формироваться. Такой нестабильный ассоциат называется активным (активированным) комплексом. Его образование можно представить следующей схемой:
Н I Н · · · I Н-I
| + | → ∶ ∶ →
Н I H · · · I Н-I
Дата добавления: 2015-08-08; просмотров: 624;
