Закон действующих масс. Зависимость скорости химической реакции от концентрации реагирующих веществ определяется законом действующих масс
Зависимость скорости химической реакции от концентрации реагирующих веществ определяется законом действующих масс. Этот закон установлен норвежскими учеными Гульдбергом и Вааге в 1867 г. Он формулируется следующим образом: при постоянной температуре скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, взятых в степенях, равных стехиометрическим коэффициентам в уравнении реакции.
Для химической реакции, протекающей по уравнению, записанному в общем виде
аА + bВ = сС + dD, (3)
математическое выражение закона действующих масс, называемое кинетическим уравнением химической реакции, имеет вид
V = k · CAa · CBb, (4)
где V – скорость химической реакции; CA, CB – молярные концентрации реагентов А и В; а и b – стехиометрические коэффициенты для реагентов А и В в уравнении реакции; k – коэффициент пропорциональности, называемый константой скорости химической реакции.
Ее физический смысл становится понятным, если принять CA = CB = 1 моль/л, тогда k = V (константа скорости численно равна скорости химической реакции при концентрациях компонентов 1 моль/л), или удельная (единичная) скорость.
Константа скорости химической реакции зависит от природы реагирующих веществ, температуры, присутствия катализатора и не зависит от концентрации реагирующих веществ.
Для гомогенных газовых систем существует прямо пропорциональная зависимость между концентрацией газов и их парциальным давлением, определяемая уравнением Менделеева-Клапейрона:
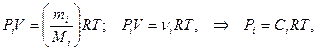 (5)
(5)
где Сi – молярная концентрация i-того компонента в системе, моль/л; Pi – парциальное давление i-того компонента в системе.
Учитывая вышесказанное, математическое выражение закона действующих масс для уравнения химической реакции (3), протекающей в газовой фазе, можно записать в виде
V = k·PAa·PBb. (6)
В случае гетерогенных реакций в математическое выражение закона действующих масс входят концентрации только тех веществ, которые находятся в газовой фазе или в растворе. Вещества, находящиеся в конденсированном состоянии (твердом или жидком), реагируют лишь на поверхности раздела фаз, которая остается неизменной, поэтому концентрация веществ (поверхностная) постоянна и входит в константу скорости. Например, для реакции горения угля:
С(тв.) + О2(г) = СО2(г)
закон действующих масс запишется так:
V = k'·Cc·CО2 = k·CО2,
где k = k'·Cc.
Дата добавления: 2015-08-08; просмотров: 1661;
