Действие электролитов на коагуляцию
Установлен ряд эмпирических закономерностей воздействия электролитов, которые известны под названием правил коагуляции:
1. Любые электролиты могут вызвать коагуляцию, однако заметное воздействие они оказывают при достижении определенной концентрации.
Порог коагуляции – минимальная концентрация электролита, вызывающая коагуляцию (g, моль/л; иногда Ск ).
Порог коагуляции определяют по помутнению, изменению окраски или по началу выделения дисперсной фазы в осадок.
2. Правило Шульце-Гарди (правило значности, эмпирическое):
Коагулирующим действием обладает тот ион электролита, который имеет заряд, противоположный заряду потенциалопределяющих ионов мицеллы (гранулы), причем, коагулирующее действие тем сильнее, чем выше заряд.
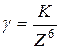
где К – коагулирующая способность (примем ее за единицу).
По правилу Шульца – Гарди значение порогов коагуляции для противоионов с зарядами 1, 2 и 3 соотносятся как 1:1/20:1/500, т.е. чем выше заряд, тем меньше требуется электролита, чтобы вызвать коагуляцию.
Например, коагулируем золь сульфида мышьяка (As2S3): или Fe(OH)2
 (As2S3) Fe(OH)2
(As2S3) Fe(OH)2
NaCl (Na+) g=5 моль/л KBr (Br-) g=12,5
MgCl2 (Mg2+) g=0,72 K2SO4 (SO42-) g=0,205
AlCl3 (Al3+) g=0,092
Правило Шульце – Гарди имеет приближенный характер и описывает действие ионов лишь неорганических соединений.
3. В ряду органических ионов коагулирующее действие возрастает с повышением адсорбционной способности.
4. В ряду неорганических ионов одинаковой зарядности их коагулирующая активность возрастает с уменьшением гидратации.
Лиотропные ряды или ряды Гофмейстера – это порядок расположения ионов по их способности гидратироваться (связывать воду).
Слово ''лиотропный'' значит ''стремящийся к жидкости'' (более подходящий термин для случая водных сред – гидротропный).
 возрастание коагулирующей активности
возрастание коагулирующей активности
Li+; Na+; K+; Rb+; Cs+
 возрастание степени гидратации
возрастание степени гидратации
Теплота гидратации: 140 117 93 86 (ккал/г-ион)
5. Очень часто началу коагуляции соответствует снижение дзета-потенциала до критического значения (около 0,03 В).
6. В осадках, получаемых при коагуляции электролитами, всегда присутствуют ионы, вызывающие ее.
Дата добавления: 2015-08-08; просмотров: 2531;
