Ход коагуляции в зависимости от концентрации коагулирующего электролита можно подразделить на две стадии: медленную и быструю.


Сэл
Ск – порог коагуляции
Рис.5.6. Зависимость скорости коагуляции от
концентрации электролита
В области медленной коагуляции скорость сильно зависит от концентрации (отрезок АВ). В точке В скорость становиться постоянной и не зависит от концентрации электролита – здесь значение z - потенциала равно нулю – начало быстрой коагуляции. Концентрацию электролита, начиная с которой скорость коагуляции остается постоянной, называют порогом быстрой коагуляции.
Теории кинетики коагуляции разработаны Смолуховским (1916г).
Рассматривают коагуляцию как реакцию второго порядка, в элементарном акте которой участвуют две частицы: 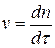 .
.
Уравнение Смолуховского для расчета числа частиц, слипшихся по m-штук за время t:
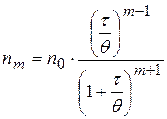 ;
;
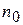 - первоначальное число частиц;
- первоначальное число частиц;
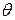 - время половинной коагуляции (
- время половинной коагуляции ( 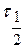 ).
).
При быстрой коагуляции все столкнувшиеся частицы реагируют (DUб=0).
Уравнение Смолуховского для константы скорости быстрой коагуляции:
 ;
;
где h- вязкость среды.
При медленной коагуляции не все столкновения приводят к слипанию. Уравнение Смолуховского для медленной коагуляции:
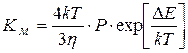 ;
;
где Р – стерический множитель, учитывающий благоприятные пространственные расположения частиц при столкновении, их физические размеры. При быстрой коагуляции все столкновения эффективны и Р=1, при медленной Р<1.
DЕ – потенциальный барьер, при быстрой коагуляции DЕ=0, при медленной DЕ¹0.
h - вязкость.
Порог коагуляции можно вычислить из соотношения, теоретически найденного Дерягиным и Ландау и названным законом 6-й степени:
энергетический барьер между коллоидными частицами исчезает при достижении критической концентрации (g), которая обратно пропорциональна шестой степени заряда иона-коагулятора:
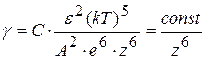 ;
;
С – константа, зависящая от числа зарядов катиона и аниона;
e - диэлектрическая проницаемость раствора;
А – константа Ван –дер –Ваальсового притяжения;
е- заряд электрона;
k – константа Больцмана;
z– зарядность коагулирующего иона.
В соответствии с этим уравнением значения g для элементов с зарядами противоионов 1, 2 и 3 соотносятся как 1:1/26:1/36=1:1/64:1/729.
Уравнение хорошо обосновывает эмпирическое правило Шульце-Гарди.
В тех случаях, когда велика роль адсорбционно-сольватного фактора устойчивости, проявляется приближенность теории ДЛФО, т.к. она не учитывает роли специфической адсорбции и сродства иона к растворителю.
Связь эффективности соударений с потенциальным барьером при коагуляции была показана Фуксом Н.А.
Если DЕ значительно больше кТ, то скорость коагуляции может приблизиться к нулю и система окажется агрегативно неустойчивой.
В теории, развитой Фуксом, используется представление о коэффициенте замедления коагуляции W, который показывает, во сколько раз константа скорости медленной коагуляции меньше константы скорости быстрой коагуляции. Учитывая выражения для Кб и Км, получим:
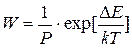
Коэффициент W называют фактором устойчивости или коэффициентом стабильности.
Дата добавления: 2015-08-08; просмотров: 1444;
