Применение
Насыщенные кислоты. Муравьиная кислота НСООН. Название связано с тем, что кислота содержится в выделениях муравьев. Широко применяется в фармацевтической и пищевой промышленности.
Уксусная кислота СН3СООН. Известна с глубокой древности, ее 5-10% растворы («столовый уксус») используют как вкусовую приправу и консервант. Консервирующее действие кислоты связано с подавлением развития гнилостных бактерий и плесневых грибков. Для пищевых целей уксусную кислоту получают ферментативным брожением винного спирта:
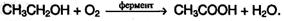
Основную часть производимой уксусной кислоты используют для производства искусственных волокон на основе целлюлозы.
Пальмитиновая С15Н31СООН и стеариновая С17Н35СООН кислоты входят в состав животных жиров и растительных масел. Натриевые и калиевые соли этих кислот входят в состав мыла.
Щавелевая кислота НООС-СООН.Широко распространена в растительном мире. В виде солей (оксалатов) содержится в листьях щавеля, кислицы, ревеня. Качественной реакцией для обнаружения щавелевой кислоты и ее солей служит образование нерастворимого оксалата кальция:
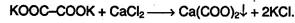
Применяется в текстильной и кожевенной промышленности.
Малоновая кислота НООС-СН2-СООН. Содержится в виде кальциевой соли в соке сахарной свеклы. Широко используется в фармацевтической промышленности.
Янтарная кислота НООС-СН2-СН2-СООН своим названием обязана тому, что содержится в янтаре (впервые выделена при сухой перегонке янтаря в XVI в.). Применяется в фармацевтической и текстильной промышленности, а также в производстве инсектицидов, смол, фотоматериалов.
Ненасыщенные кислоты.Характерной особенностью простейших ненасыщенных кислот – акриловой и метакриловой (СН2=С(СН3)-СООН) – является склонность к полимеризации. При полимеризации эфиров или нитрилов этих кислот получают ценные вещества. В частности, полиакрилонитрил – основа волокна нитрон, используемого для производства лечебного белья.
Жирные ненасыщенные кислоты. Одной из наиболее распространенных во многих растениях и организмах животных является олеиновая кислота; она содержится в оливковом масле (от которого и произошло ее название), а также в свином жире. Особенно нужно подчеркнуть роль линоленовой и линоленовой кислот как соединений, незаменимых для человека (в организме они не могут быть синтезированы и должны поступать с пищей в количестве около 5 г в день).
По этой причине эти кислоты относят к так называемым незаменимым жирным кислотам. Линолевая и линоленовая кислоты содержатся в основном в растительных маслах. Они способствуют снижению содержания в крови холестерина – одного из факторов развития атеросклероза.
Ароматические кислоты.Бензойная кислота широко распространена в природе. Содержится в различных растительных смолах, ягодах клюквы, брусники, черники. Применяют в фармацевтической промышленности для синтеза душистых веществ и красителей, а также в качестве консерванта для пищевых продуктов. Фталевые кислоты находят широкое применение в производстве высокомолекулярных соединений.
Гетерофункциональные кислоты. Наиболее известные представители оксокислот – молочная, яблочная (гидроксибутандиовая), лимонная (2-гидроксипропан-1,2,3-трикарбоновая) и салициловая (2-гидроксибензойная).
Яблочная и лимонная кислоты являются метаболитами цикла Кребса, который также называют циклом лимонной кислоты. Молочная кислота образуется в мышцах человека и животных при интенсивной мышечной работе. Молочная кислота образуется при молочнокислом брожении:

Такие процессы идут при квашении капусты, приготовлении сыра, силосовании кормов. Молочная кислота используется как консервирующее средство в пищевой промышленности. Она применяется также в текстильной промышленности, в кожевенном производстве, как исходное вещество во многих синтезах. Яблочная и лимонная кислоты применяются в пищевой промышленности. Лимонная кислота находит применение в медицине, входит в состав комбинированного препарата «цитрамон» и других лекарственных средств. 5% раствор цитрата натрия используется для консервирования крови.
Мыла и моющие средства. Натриевые и калиевые соли высших жирных кислот называют мылами, т.к. они обладают хорошими моющими свойствами. Натриевые соли составляют основу твердых мыл, в то время как калиевые соли – жидких. Их получают кипячением животного сала либо растительного масла с гидроксидом натрия или калия – отсюда старинное название щелочного гидролиза жиров – «омыление». Очищающие (моющие) свойства мыла объясняются смачивающей способностью растворимых солей высших жирных кислот, т.е. анионы мыла обладают сродством, как к жирным загрязнениям, так и к воде. Анионная карбоксигруппа обладает сродством к воде: она гидрофильна. Углеводородная же цепь жирной кислоты обладает сродством к жирным загрязнениям. Она представляет собой гидрофобный конец молекулы мыла. Этот конец растворяется в капле грязи, в результате чего происходит ее трансформация и превращение в мицеллу. Удаление «пенообразных» мицелл с загрязненной поверхности достигается ее промыванием водой.
В так называемой жесткой воде, содержащей ионы Са2+ и Мg2+ происходит уменьшение моющей способности мыла, поскольку, взаимодействуя с ионами кальция и магния, мыла образуют нерастворимые кальциевые и магниевые соли, например:
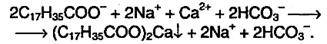
В результате этого мыло образует вместо пены хлопья на поверхности воды и расходуется бесполезно. Этого недостатка лишены синтетические моющие средства (детергенты), представляющие собой натриевые соли различных сулъфокислот общей формулы:
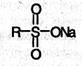
Распространенными синтетическими моющими средствами (детергентами) являются алкилбензолсульфонаты:
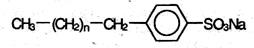
Правда, повсеместное использование синтетических детергентов (стиральные порошки) создает свои проблемы. Типичный стиральный порошок содержит приблизительно 70% синтетического моющего средства и приблизительно 30% неорганических фосфатов. Фосфаты удаляют растворимые соли кальция. К сожалению, эти фосфаты попадают в сточные воды, которые сбрасываются в ручьи, реки, озера или океаны. Фосфаты являются питательной средой для определенных водорослей. Это приводит к сильному разрастанию цианобактерий, особенно в замкнутых водоемах, например, в озерах.
Дата добавления: 2015-08-08; просмотров: 1251;
