Коллоидные (коллоидно-дисперсные) системы
Коллоидные системы (золи) – это гетерогенные системы, состоящие из частиц размером порядка 10–7–10–9 м. По размеру частиц коллоидные системы занимают промежуточное положение между истинными растворами низкомолекулярных веществ (размеры частиц, т.е. молекул и ионов, менее 10–9 м) и грубодисперсными системами.
Коллоидные частицы обычно имеют сложную структуру, которая зависит от условий получения золей, стабилизатора и других факторов. Рассмотрим строение коллоидных частиц хлорида серебра, полученного методом химической конденсации.
Если к раствору хлорида натрия прибавлять постепенно раствор нитрата серебра, то получающиеся в начале реакции молекулы хлорида серебра соединяются, образуя более крупные агрегаты, состоящие из чередующихся ионов. В этот момент в растворе создается избыток ионов Cl–. Образующиеся ультрамикрокристаллы хлорида серебра адсорбируют из раствора находящиеся в нем в избытке ионы Cl–. Согласно правилу Панета-Фаянса – адсорбируются преимущественно ионы, входящие в состав агрегата, сходные с ними или образующие нерастворимые осадки с ионами агрегата.В результате частицы осадка AgCl оказываются отрицательно заряженными и составляет ядро коллоидной частицы: m(AgCl) ∙ nCl–. Заряд ядра компенсируется эквивалентным зарядом противоположно заряженных ионов (противоионов), в данном случае ионов Na+, причем часть противоионов прочно связана с ядром и находится непосредственно у поверхности ядра. Эти противоионы помимо электростатических сил испытывают силы адсорбционного притяжения поверхности и называются противоионами адсорбционного слоя, их число равно (п – х). Остальная часть противоионов, число которых равно х, расположена диффузно и составляет диффузный слой.
При обратном порядке смешения растворов, т. е. при медленном прибавлении хлорида натрия к раствору нитрата серебра, в растворе получается избыток ионов Ag+, в результате чего образующиеся зародыши кристаллов AgCl адсорбируют на своей поверхности из раствора ионы Ag+ и заряжаются положительно.
Таким образом, формулы мицелл гидрозоля хлорида серебра в избытке хлорида натрия (I) и хлорида серебра в избытке нитрата серебра (II) можно записать так:
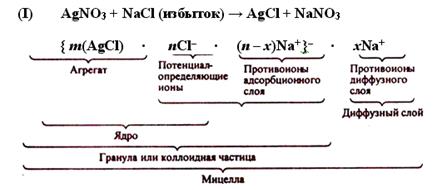
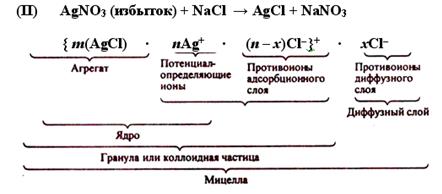
Мицелла золя является электронейтральной.
Заряженную часть мицеллы, обозначенную в формуле фигурными скобками, называют гранулой или коллоидной частицей. Потенциал, возникающий на поверхности гранулы, называют электрокинетическим потенциалом, численно равный работе, которую нужно совершить при переносе единицы заряда с поверхности гранулы в глубь дисперсионной среды или наоборот.
В том и другом случае образующиеся ультрамикрокристаллы AgCl приобретают определенные электрические заряды (положительные или отрицательные) за счет адсорбции избыточных ионов израствора. Наличие одноименных зарядов у частиц препятствует сцеплению их и дальнейшему росту кристаллов. В результате ультра-микрокристаллы AgCl с адсорбированными на них ионами Cl– или Ag+ приобретают устойчивость и остаются в жидкости, образуя коллоидный раствор.
Дата добавления: 2015-08-08; просмотров: 1684;
