Квантовые числа электронов
Главное квантовое число п определяет общую энергию электрона на данной орбитали (п = 1, 2, 3, ...). Главное квантовое число для атомов известных элементов имеет семь значений: 1, 2, 3, 4, 5, 6, 7. Число энергетческих уровней в атом равно номеру периода, в котором элемент расположен.
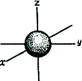
Побочное (орбитальное) квантовое число l(l = 0, 1, ..., п - 1) определяет различное энергетическое состояние электронов принадлежащих к различным подуровням данного энергетического уровня. Обычно численные значения l принято обозначать буквенными символами s, p, d, f. В этом случае говорят о s-, p-, d‑, f-орбиталях. Электрон с наибольшей вероятностью движется вокруг ядра, образуя электронное облако, форма которого в s-, p-, d‑, f-состояниях различна. Форма электронного облака зависит от значения побочного квантового числа l. Так, если l = 0 (s-орбиталь), то электронное облако имеет шаровидную форму (сферическую симметрию) и не обладает направленностью в пространстве. При l = 1 (р-орбиталь) электронное облако имеет форму гантели, т.е. форму тела вращения, полученного из «восьмерки». Формы электронных облаков d- и f-электронов намного сложнее.
Форма и направленность в пространстве электронных облаков s- и р-орбиталей:
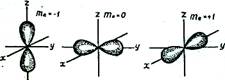
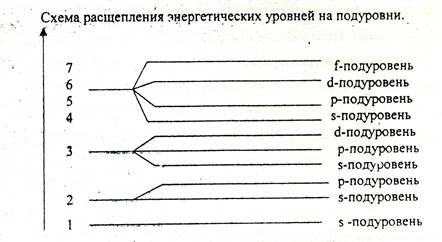
Первый уровень имее только s-подуровень, второй расщепляется на s- и р-подуровни, третий – на s-, p-, d-подуровни, четвертый, пятый, шестой и седьмой на s-, p-, d-, f-подуровни.
Магнитное квантовое число ml характеризует ориентацию орбитали в пространстве, обусловленную орбитальным магнитным моментом электрона, т.е. появлением магнитного поля (от - l до + l, включая 0, т.е. всего 2l + 1). Каждый энергетический подуровень содержит определенное число орбиталей: s-подуровень состоит из одной орбитали, р-подуровень – из трех, d-подуровень – из пяти, f-подуровень – из семи орбиталей. Графически орбиталь изображается в виде квантовой (энергетической) ячейки.
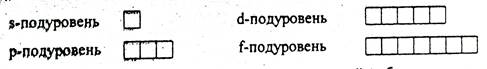
Максимальное число электронов на одной орбитали определяется числом значений спинового квантового числа.
Спиновое квантовое число тs отражает наличие у электрона собственного момента импульса(от анг. spin – вращение). Для всех электронов абсолютное значение спина всегда равно s = ½ (+½ или -½). Графически электроны с тs = +½ изображаются стрелкой ↑, а электроны с тs = -½ стрелкой ↓. Одну орбиталь могут занимать только электроны, имеющие противоположные спины, называют электронами с антипараллельными спинами и обозначают ↑↓.
Дата добавления: 2015-08-08; просмотров: 1240;
