Лекция 19. 1. Примеры решения стационарного уравнения Шредингера
Основные выводы.
1. Примеры решения стационарного уравнения Шредингера
1.1. Частица в одномерной бесконечно глубокой потенциальной яме шириной l. (U отвечает требованиям: U = 0 при 0< x <l; U = ∞ при х = 0 и х = l.) Решение существует при (значениях энергии 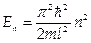 , где n = 1,2,3.... Эти значения Еп называются собственными значениями энергии, а соответствующие им решения ψп — собственными функциями.
, где n = 1,2,3.... Эти значения Еп называются собственными значениями энергии, а соответствующие им решения ψп — собственными функциями.
1.2. Гармонический осциллятор имеет потенциал 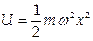 . Ему соответствует уравнение Шредингера
. Ему соответствует уравнение Шредингера 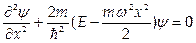 . Это уравнение имеет решения при дискретных значениях энергии
. Это уравнение имеет решения при дискретных значениях энергии 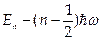 , п = 0, 1, 2 ...
, п = 0, 1, 2 ...
1.3. Прохождение частицы через потенциальный барьер высотой Uо и шириной l при энергии частицы Е меньшей высоты потенциального барьера Uo (туннельный эффект).
В одномерном случае необходимо решить уравнение Шредингера при условиях: U = 0 при х < 0; U = Uoпри 0≤ x ≤l; U = 0 при х > l.
Коэффициент прозрачности туннельного аффекта:  .
.
2. Уравнение Шредингера для атома с потенциальной кулоновской энергией U = – Ze2/r в сферической системе координат r, θ, j
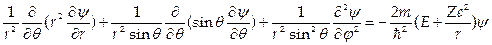
имеет решения при собственных значениях энергии 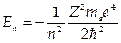 ,где п =1,2,3.... Соответствующие собственные функции ψn,l,v(r,θ,j) содержат три целочисленных параметра n, l, m. При этом n определяет энергию электрона, l — его орбитальный момент и m — магнитное квантовое число определяет проекцию орбитального момента на выбранную ось.
,где п =1,2,3.... Соответствующие собственные функции ψn,l,v(r,θ,j) содержат три целочисленных параметра n, l, m. При этом n определяет энергию электрона, l — его орбитальный момент и m — магнитное квантовое число определяет проекцию орбитального момента на выбранную ось.
Электрон обладает собственным моментом импульса, который носит название спин. Проекция спина на любую ось может принимать два значения + 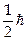 и –
и – 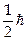 . Состояние каждого электрона в атоме характеризуется четырьмя квантовыми числами: главное n (n = 1, 2,3...), орбитальное l (l = 0,1, 2... n–1), магнитное m (m = –l, –l + 1...0... +l), проекция спина S (S =+
. Состояние каждого электрона в атоме характеризуется четырьмя квантовыми числами: главное n (n = 1, 2,3...), орбитальное l (l = 0,1, 2... n–1), магнитное m (m = –l, –l + 1...0... +l), проекция спина S (S =+ 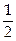 , –
, – 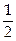 )
)
3.Принцип запрета Паули:
В любой квантовой системе, в том числе в атоме, не может находится двух и более электронов с одинаковыми квантовыми числами n, l, m и S.
4. Уравнение Шредингера и принцип запрета Паули позволяют объяснить периодический закон Менделеева — периодическую зависимость химических свойств элементов от атомного номера Z. Атомный номер определяет количество электронов в атоме и заряд атомного ядра. При данном n (на данном энергетическом уровне) может находится не более 2n2 электронов. Электроны с одинаковым n образуют оболочку. Обозначаются оболочки буквами К, L, М, N... для n = 1, 2, 3, 4 ... С увеличением Z происходит заполнение оболочек. При этом на К-оболочке не может находится более 2 электронов, на L—оболочке — более 8 электронов и т.д. Электроны, находящиеся на высшей оболочке называются валентными и определяют химические свойства элементов. Число их периодически повторяется, что и объясняет периодическую повторяемость химических свойств элементов.
Дата добавления: 2015-08-08; просмотров: 883;
