Основное уравнение электрохимической кинетики
ik = ia = i0,
где i0 – ток обмена,

(окислительно-восстановительные реакции).
При катодной поляризации на электроде через систему протекает ik преимущественно, если поляризация не слишком велика, то суммарная скорость процесса равна:
i = ik – ia,
для реакции (1) катодные и анодные токи будут равны:
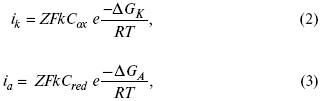
где Z – количество электронов, участвующих в реакции;
F – число Фарадея;
к – const скорости;
Сox, Cred – концентрация окислительной и восстановленной форм реагентов;
ΔGK – энергия активации катодного процесса;
ΔGA – энергия активации анодного процесса.
Энергия активации зависит от величины накладываемого потенциала, в то же самое время эта энергия распределяется между прямой и обратной реакцией в соответствии с коэффициентом переноса – а, т. е.
υ = υпр – υоб.
Коэффициент переноса α– доля энергии электрического поля в ДЭС, которая приходится на прямую и обратную реакции.
α– коэффициент переноса для катодной реакции;
(1 – α) – для анодного процесса (коэффициент переноса).
ΔGk = ZFE α, (4)
ΔGA = ZFE(1 – α) (5)
С учетом уравнений (4), (5) уравнения (2), (3) примут следующий вид:
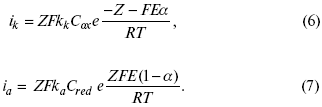
Различие знаков у электрона объясняется тем, что катодная поляризация («–») ускоряет прямую реакцию и замедляет обратную реакцию.
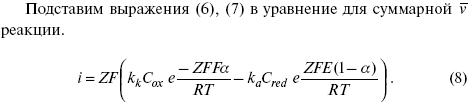
Введем в уравнение (8) плотность тока обмена – i0.
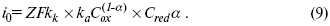
Вместо потенциала введем перенапряжение:
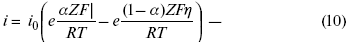
полное уравнение поляризационной кривой.
Вывод из уравнения (10):
1) при равновесном потенциале, когда ток равен нулю, уравнение (10) преобразуется в уравнение Нернста:
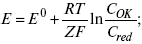
2) при малых величинах η:
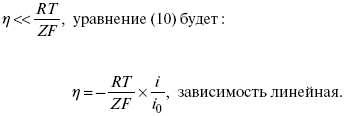
При сдвижении потенциала от равновесного (59 mВ);

η = a + b ln i– уравнение Тафеля в простом виде при замедлении стадии переноса заряда.
Величина i0 (тока обмена) и α(коэффициента переноса) – основные кинетические параметры стадии переноса заряда (q). Они могут быть определены из экспериментальных измерений, для этого на исследуемом электроде снимают зависимость η– i или Ei – i.
Поляризационная кривая судит о коррозионной стойкости металлов.
Перестраиваем поляризационную кривую в координаты:
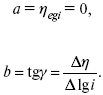
Определяем const а и bв уравнении Тафеля, определяем b:
Из коэффициента bнайдем а, после подставим в а и найдем i0.
Перенапряжение Н2 (водорода).
Источник выделения Н2 – Н2SO4 →Н++ НSO4–
Источник выделения Н2 – Н2О →Н++ ОН-.
В рН < 7 Н2 выделяется по реакции.
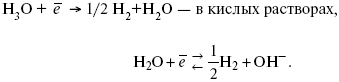
Н2 всегда выделяется в потенциалах более отрицательных, чем равновесный потенциал, то есть с перенапряжением.
Суммарный процесс выделения водорода состоит из следующих стадий:
1) доставка к поверхности катода реагирующих частиц Н3О+;
2) разряд Н3О+ с образованием Надс
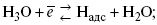
3) удаление выделяющегося Надс с поверхности электрода может происходить тремя путями:
а) каталитическая рекомбинация
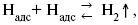
где Кat – материал катода;
б) электрохимическая десорбция – удаление Н2 происходит на уже адсорбированных атомах
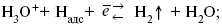
в) эмиссия включает две стадии:
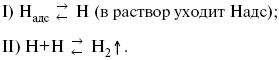
Для Pt замедлена стадия а), для других металлов (Hg, Pb) – стадия разряда, Н+ – самый подвижный.
Дата добавления: 2015-08-08; просмотров: 2441;
