Скорость и время реакции

Подтверждается закон Гульдберга-Вааге – профессора химии Гульдерга и молодого ученого Вааге).
Рассмотрим следующий фактор – температуру.
При увеличении температуры скорость большинства химических реакций повышается. Эта зависимость описана правилом Вант-Гоффа: «При повышении температуры на каждые 10 °C скорость химических реакций увеличивается в 2 – 4 раза».
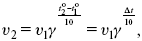
где γ – температурный коэффициент, показывающий, во сколько раз увеличивается скорость реакции при повышении температуры на 10 °C;
v1 – скорость реакции при температуре t1;
v2 – скорость реакции при температуре t2.
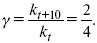
Например, реакция при 50 °С протекает за две минуты, за сколько времени закончится процесс при 70 °С, если температурный коэффициент γ= 2?
Решение:
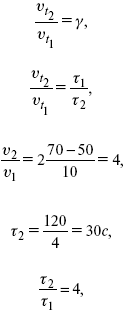
t1 = 120 с = 2 мин; t1 = 50 °С; t2 = 70 °С.
Даже небольшое повышение температуры вызывает резкое увеличение скорости реакции активных соударений молекулы. Согласно теории активации, в процессе участвуют только те молекулы, энергия которых больше средней энергии молекул на определенную величину. Эта избыточная энергия – энергия активации. Физический смысл ее – это та энергия, которая необходима для активного столкновения молекул (перестройки орбиталей). Число активных частиц, а следовательно, скорость реакции возрастает с температурой по экспоненциальному закону, согласно уравнению Аррениуса, отражающему зависимость константы скорости от температуры
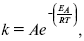
где А – коэффициент пропорциональности Аррениуса;
k– постоянная Больцмана;
ЕА – энергия активации;
R – газовая постоянная;
Т– температура.
Катализатор – вещество, ускоряющее скорость реакции, которое само при этом не расходуется.
Катализ– явление изменения скорости реакции в присутствии катализатора. Различают гомогенный и гетерогенный катализ. Гомогенный– если реагенты и катализатор находятся в одном агрегатном состоянии. Гетерогенный– если реагенты и катализатор в различных агрегатных состояниях. Про катализ см. отдельно (дальше).
Ингибитор– вещество, замедляющее скорость реакции.
Следующий фактор – площадь поверхности. Чем больше поверхность реагирующего вещества, тем больше скорость. Рассмотрим на примере влияние степени дисперсности на скорость реакции.
CaCO3 – мрамор. Плиточный мрамор опустим в соляную кислоту HCl, подождем пять минут, он растворится полностью.
Порошкообразный мрамор – с ним проделаем ту же процедуру, он растворился через тридцать секунд.
Уравнение обоих процессов одинаково.
CaCO3(тв) + HCl(г) = CaCl2(тв) + H2O(ж) + CO2(г) ↑.
Итак, при добавлении порошкообразного мрамора время меньше, чем при добавлении плиточного мрамора, при одинаковой массе.
Дата добавления: 2015-08-08; просмотров: 813;
