ЭДС. Закон Ома для полной цепи.
Закон Ома для замкнутой цепи.I=ƹ/R+r
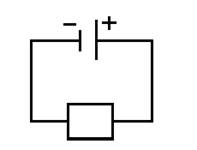
Сила тока в замкнутой цепи равно отношению ЭДС источника тока к суммарному сопротивлению всей цепи. R- сопротивление внешней цепи. r- внутреннее сопротивление источника ЭДС.
 ЭДС
ЭДС
Ƹ=A/q (B)
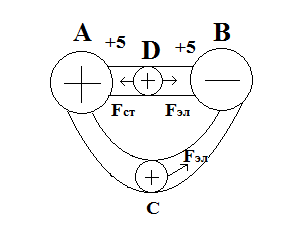
По этому для существования постоянного тока необходимо наличие в цепи наличие источника ЭДС, в которых на заряд должны действовать строение силы Fст., направленные против сил электрического поля и превышающие их по величине. Тогда на участке BDA носители тока под действием сторонних сил будет двигаться от B к A.
Силы не электрического происхождения, действуют на заряды со стороны источников ЭДС. Строение силы разделяют разноименные заряды в электронной цепи, создавал в ней разность потенциалов.
Природа сторонних сил может быть различной. Например: в гальванических элементах они возникают за счет энергии химических реакций между электронами и электролитами.
Источник тока- устройство в котором действуют сторонние силы.
Основные характеристики источника тока- электродвижущие силы (ƹ) и внутреннее сопротивление (r). Всякий источник тока имеет зажимы полюсы, с которых снимаются генерируемая разность потенциалов.
16. Электрический ток в электролитах. Законы электролиза. Использование электролиз.
Электролиты- растворы кислот, солей и щелочей.
Электролитическая диссоциация- распад молекул на ионы под действием растворителя (воды).
HCl↔ H+ + Cl
Электролиз- выделение из раствора чистого вещества при помощи электрического тока.
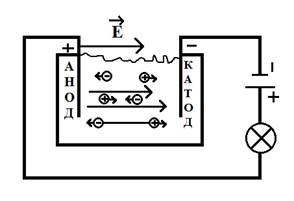
Положительные ионы (катионы) движутся к катоду, отрицательные (анионы) к аноду через раствор пройдет электрический ток.
Ток в электролитах- это направленное движение ионов.
Достигнув катода катионы присоединяют к себе электроны и превращаются в нейтральные молекулы. Аноды, достигнув анода отдают ему избыточные электроны и так же превращаются в нейтральные молекулы. В итоге на электродах выделяется чистое вещество.
Законы электролиза Фарадей:
| m=k*q (кг) m=k*i*t m- масса выделенного вещества. q- заряд. I- сила тока. k- электрохимический эквивалент вещества. | k=1/F*A/n F=96 500 Кл/моль n- валентность вещества. |
Применение электролиза:
1. В цветной металлургии: при получении алюминия, меди, цинка из раствора их солей.
2. Производят отчистку меди от примесей.
3. Получают металлические рельефные различных фигур, клеймо (заготовка) для печатания денежных знаков, матрица для печатания книг и газет (гальванопла)
4. В аккумуляторах.
Дата добавления: 2015-08-08; просмотров: 919;
