Хирургическое лечение тахиаритмий 2 страница
Во всех современных эпидемиологических исследованиях, посвященных изучению ФР ИБС и атеросклероза, подчеркивается тесная связь, существующая между ожирением и такими ФР как АГ, ГЛП и сахарный диабет. Именно эта взаимосвязь, наряду с независимым влиянием ожирения как такового, играет главную роль в увеличении степени риска сердечно-сосудистых заболеваний у лиц, страдающих избыточной массой тела.
Ожирению сопутствует ряд ГЛП, предрасполагающих к развитию ИБС, включая гиперхолестеринемию, гипертриглицеридемию, снижение уровня ХС ЛВП, повышение уровня апопротеина В и мелких плотных частиц ЛНП. Ожирение существенно повышает риск возникновения сахарного диабета I и II типа. Так, у женщин, прибавивших в весе после 18 лет всего 5–7,9 кг, риск возникновения сахарного диабета вдвое больше, чем у женщин со стабильной массой тела. У женщин с прибавкой массы тела 8 кг и более риск увеличивается в 3 раза. Характерно, что у пациентов среднего возраста, похудевших по разным причинам более чем на 5 кг, риск возникновения сахарного диабета уменьшается наполовину.
Следует также иметь в виду, что ожирение закономерно сопровождается увеличением активности адипоцитов брюшной полости, которые секретируют свободные жирные кислоты непосредственно в систему воротной вены, что подавляет поглощение инсулина печенью. В результате повышается концентрация инсулина в периферическом кровотоке и снижается чувствительность тканей к инсулину, т.е. развивается инсулинорезистентность. Кроме того, высокие концентрации свободных жирных кислот способствуют повышению содержания ТГ в крови.
В последние годы много внимания уделяется изучению клинической картины и патогенеза так называемого “метаболического синдрома” (“синдрома Х”), который очень часто сочетается с ожирением. В основе этого синдрома лежит, как известно, наличие инсулинорезистентности, гипертриглицеридемии и АГ. У лиц с метаболическим синдромом существенно повышен риск возникновения ИМ, внезапной смерти и сахарного диабета. В связи с этим N.M. Kaplan предложил называть сочетание таких ФР как ожирение, инсулинорезистентность, ГЛП и АГ “смертельным квартетом”. Инсулинорезистентность и гиперинсулинемия рассматриваются в настоящее время в качестве пусковых факторов, инициирующих целый ряд механизмов, приводящих в конечном счете к развитию на фоне ожирения ГЛП, АГ и ИБС.
Наконец, следует учитывать, что ожирение закономерно сопровождается активацией РАС и САС, а также уменьшением секреторного ответа натрийуретического пептида, что также оказывает влияние на патогенез атеросклероза, ИБС и АГ.
 Запомните
1. Ожирение является не только самостоятельным и независимым ФР атеросклероза и других сердечно-сосудистых заболеваний, но и, возможно, одним из пусковых механизмов других ФР, например АГ, ГЛП, инсулинорезистентности и сахарного диабета. 2. Сочетание ожирения, инсулинорезистентности, гипертриглицеридемии и АГ, иногда называемое “смертельным квартетом” (N.M. Kaplan), отличается особенно высоким риском развития атеросклероза и его осложнений и лежит в основе формирования так называемого метаболического синдрома (“синдрома Х”). Запомните
1. Ожирение является не только самостоятельным и независимым ФР атеросклероза и других сердечно-сосудистых заболеваний, но и, возможно, одним из пусковых механизмов других ФР, например АГ, ГЛП, инсулинорезистентности и сахарного диабета. 2. Сочетание ожирения, инсулинорезистентности, гипертриглицеридемии и АГ, иногда называемое “смертельным квартетом” (N.M. Kaplan), отличается особенно высоким риском развития атеросклероза и его осложнений и лежит в основе формирования так называемого метаболического синдрома (“синдрома Х”).
| ||
| 4.1.5. Сахарный диабет | ||

| ||
Сахарный диабет I и II типа сочетается со значительным увеличением заболеваемости атеросклерозом и тяжестью течения многих его клинических проявлений. Риск развития сердечно-сосудистых заболеваний увеличивается в 2–4 раза у мужчин и в 3–7 раз у женщин. При сахарном диабете I типа дефицит инсулина приводит к снижению активности липопротеидлипаз и, соответственно, увеличению синтеза триглицеридов. Сахарный диабет II типа часто сочетается с гиперлипидемией IV типа (подробнее см. ниже) и увеличением синтеза ЛОНП и ЛНП. Особенно неблагоприятным является сочетание нарушений углеводного обмена с некоторыми другими ФР: гипертриглицеридемией, АГ, курением и ожирением. По сути сахарный диабет II типа в большинстве случаев развивается в результате имеющейся у больного инсулинорезистентности, которая при сочетании с ожирением, АГ и гипертриглицеридемией ведет к возникновению метаболического синдрома. Иными словами, в основе развития и атеросклероза, и части случаев сахарного диабета лежат одни и те же механизмы, а само наличие сахарного диабета является, таким образом, маркером наиболее тяжелого течения атеросклероза.
Для сахарного диабета чрезвычайно характерен процесс гликозилирования ЛП с образованием модифицированных форм ЛНП и ЛВП. Как и модифицированные ЛП, образующиеся в результате перекисного окисления липидов (см. выше), гликозилированные ЛНП отличаются меньшим сродством к специфическим В- и Е-рецепторам гепатоцитов, что, по понятным причинам, способствует уменьшению скорости элиминации ЛП. Гликозилированные ЛНП вызывают также повреждение эндотелия, активируют проникновение моноцитов в интиму артерий, трансформацию макрофагов в пенистые клетки, а также пролиферацию гладкомышечных клеток, способствуя тем самым развитию атеросклероза (Baynoss, 1991).
| 4.1.6. Возраст |

|
Имеется линейная зависимость между заболеваемостью атеросклерозом и возрастом. Чем больше возраст, тем сильнее выражен атеросклероз и чаще встречаются тяжелые клинические проявления атеросклероза (ИБС, инфаркт миокарда, ишемический инсульт и др.). В то же время в последние годы в экономически развитых странах отмечается значительный рост заболеваемости среди сравнительно молодых лиц (моложе 50 лет).
| 4.1.7. Пол |

|
До 55 лет заболеваемость ИБС, церебральным и периферическим атеросклерозом среди мужчин в 3–4 раза выше, чем среди женщин. В более старшей возрастной группе (старше 65–70 лет) заболеваемость выравнивается. Это связывают с содержанием у женщин эстрогенов, которые вызывают, вероятно, вазопротективный эффект, оказывая влияние, в частности, на липидный обмен. Так, до наступления менопаузы у женщин наблюдается более высокое содержание ХС ЛВП и более низкая концентрация ХС ЛНП. При этом риск развития ИБС, инфаркта миокарда и мозгового инсульта примерно в 8–10 раз меньше, чем у мужчин того же возраста. В менопаузе защитное действие эстрогенов уменьшается и риск возникновения осложнений атеросклероза увеличивается.
В целом мужчины заболевают атеросклерозом на 10 лет раньше, чем женщины.
| 4.1.8. Наследственность |

|
Риск развития атеросклероза существенно повышается у лиц, близкие родственники которых страдали ИБС, церебральным и периферическим атеросклерозом. Причем такая наследственная предрасположенность проявляется преимущественно у пациентов сравнительно молодого и среднего возраста (до 55 лет). В более старших возрастных группах генетические факторы оказываются, по-видимому, менее значимыми, уступая место многочисленным приобретенным ФР (АГ, сахарный диабет, курение, ожирение и т.д.).
Наследственная предрасположенность к сравнительно раннему возникновению атеросклероза связана, вероятно, с генетически детерминированным повреждением различных звеньев метаболизма липидов, структуры и функции эндотелия, активности ферментных систем гладкомышечных клеток, особенностями функционирования сосудисто-тромбоцитарного и коагуляционного гемостаза и т.п. Так, первичная семейная комбинированная гиперлипидемия с умеренным повышением ЛНП, ЛОНП и ТГ наблюдается у  больных, перенесших ИМ в возрасте младше 55 лет. Генетически детерминированное низкое содержание в плазме крови антиатерогенных ЛВП встречается примерно у 25% больных с ранним развитием ИБС (А.Я. Ивлева).
больных, перенесших ИМ в возрасте младше 55 лет. Генетически детерминированное низкое содержание в плазме крови антиатерогенных ЛВП встречается примерно у 25% больных с ранним развитием ИБС (А.Я. Ивлева).
Учитывая многочисленность этиологических факторов, оказывающих влияние на различные звенья патогенеза атеросклероза, есть основания считать, что наследственная предрасположенность к различным нарушениям обмена, лежащим в основе развития атеросклероза, встречается еще чаще.
| 4.1.9. Гиподинамия |

|
Малоподвижный образ жизни является важнейшим фактором формирования целого ряда заболеваний сердечно-сосудистой системы: АГ, ИБС, атеросклероза и др. У лиц с низкой физической активностью, как правило, наблюдаются неадекватные реакции сердечно-сосудистой, дыхательной, нервной и других систем на любые внешние воздействия, в том числе психоэмоциональный стресс: возникает чрезмерная активация САС, РАС, усиливается выброс в кровяное русло катехоламинов и других биологически активных веществ, так или иначе оказывающих повреждающее действие на сосудистую систему, миокард и проводящую систему сердца.
Недостаточная физическая активность закономерно сопровождается развитием ожирения, нарушениями липидного обмена, склонностью пациентов к спастическим реакциям, повышению АД, снижению скорости метаболических процессов, что также способствует развитию атеросклероза. В исследовании MRFIT, например, было показано, что у пациентов со сниженной физической активностью смертность от ИБС на 27% выше, чем у лиц, которые регулярно подвергались физическим нагрузкам.
| 4.1.10. Нерациональное питание |

|
Давно замечено, что высококалорийное питание с большим содержанием в пищевом рационе животных жиров является важнейшим ФР атеросклероза. Такой характер питания способствует развитию ожирения, нарушениям углеводного и липидного обменов, которые лежат в основе формирования атеросклероза. Так, при хроническом употреблении в пищу продуктов с высоким содержанием насыщенных жирных кислот и ХС (преимущественно животный жир) в гепатоцитах накапливается избыточное количество ХС и по принципу отрицательной обратной связи (см. выше) в клетке снижается синтез специфических ЛНП-рецепторов и, соответственно, уменьшается захват и поглощение гепатоцитами атерогенных ЛНП, циркулирующих в крови.
| 4.1.11. Гипергомоцистеинемия |

|
Гипергомоцистеинемия относится к сравнительно “новым” и окончательно не доказанным ФР атеросклероза (Е. Braunwald, G. Taylor). Тем не менее в ряде исследований показана высокая корреляция между уровнем гомоцистеина в крови и риском развития атеросклероза, ИБС и ишемической болезни мозга (ИБМ). Имеются данные, что примерно 20–25% больных атеросклерозом имеют повышенный уровень гомоцистеина в сравнении с 2% лиц контрольной группы (G. Taylor).
Гомоцистеин преставляет собой деметилированное производное незаменимой аминокислоты метионина, поступающего в организм с пищей. Циркулирующий в крови гомоцистеин подвергается внутриклеточному метаболизму с образованием цистатионина, который в дальнейшем превращается в цистеин. Важно помнить, что нормальный метаболизм гомоцистеина возможен только с участием ферментов, кофакторами которых являются витамины В6, В12 и фолиевая кислота. Соответственно, дефицит этих витаминов приводит к повышению содержания в крови гомоцистеина.
Механизм атерогенного действия гомоцистеина пока не выяснен. Предполагают, что в присутствии гомоцистеина протеогликаны клеток сосудистой стенки теряют способность к поперечной сшивке и формированию нормальной здоровой ткани (О.Ш. Ойноткинова и Ю.В. Немытин, 2001). Поврежденные гомоцистеином, они образуют в стенке артерий не волокнистую, а гранулированную структуру и, склеиваясь друг с другом, образуют своеобразные крупные “комки” на поверхности которых откладываются атерогенные ЛП.
Кроме того, повышенное содержание гомоцистеина активирует перекисное окисление липидов и образование модифицированных ЛНП, повреждающих эндотелий сосудистой стенки, ингибирующих продукцию эндотелиального вазодилатирующего фактора (NO) и способствующих пролиферации гладкомышечных клеток и образованию пенистых клеток (см. ниже).
| 4.1.12. Воспаление и инфекции |

|
В последние годы в литературе широко обсуждается вопрос о роли воспаления в формировании неосложненной и осложненной атеросклеротической бляшки (Ross и Harker). К настоящему времени получено много доказательств наличия такого воспаления в очаге атеросклеротического поражения: присутствие в нем большого количества макрофагов, активированных Т-лимфоцитов, тучных клеток, тромбоцитов и т.д. Продукция этими клетками различных цитокинов (в первую очередь, фактора некроза опухолей a, интерлейкинов и др.), действительно, может способствовать повреждению сосудистого эндотелия и “пропитыванию” интимы модифицированными атерогенными ЛП. Известные маркеры воспаления, в том числе повышенный уровень СR-протеина, скорее указывают не на наличие атеросклеротического поражения сосудистой стенки, а на нестабильность атеросклеротической бляшки, котoрая лежит в основе формирования так называемого острого коронарного синдрома — нестабильной стенокардии и острого ИМ.
В последние годы определенное значение в генезе атеросклеротических поражений придается цитомегаловирусной и хламидийной инфекции, широко распространенной среди взрослого населения. Антигены этих возбудителей нередко обнаруживают в атеросклеротических бляшках, а высокие титры антител определяются у значительной части больных ИБС. Имеются данные о том, что хламидийная инфекция ассоциируется с большим риском смертельных и несмертельных обострений ИБС (Saikku с соавт.). Предполагают, что присутствие хламидий в сосудистой стенке способствует окислению (модификации) ЛНП, что сопровождается повреждением эндотелия и образованием пенистых клеток, участвующих в формировании атеросклеротической бляшки.
Тем не менее вопрос о правомочности отнесения цитомегаловирусной и хламидийной инфекции к числу ФР атеросклероза и ИБС требует дальнейших исследований и более убедительных доказательств.
 Запомните
К числу наиболее значимых модифицируемых ФР атеросклероза, поддающихся коррекции, относятся: 1. Дислипидемии (увеличение содержания ЛНП, ЛП (a) и ЛОНП и уменьшение ЛВП). 2. Артериальные гипертензии. 3. Курение. 4. Ожирение (часто сопровождающееся инсулинорезистентностью). 5. Сахарный диабет. 6. Гиподинамия. 7. Нерациональное питание. Запомните
К числу наиболее значимых модифицируемых ФР атеросклероза, поддающихся коррекции, относятся: 1. Дислипидемии (увеличение содержания ЛНП, ЛП (a) и ЛОНП и уменьшение ЛВП). 2. Артериальные гипертензии. 3. Курение. 4. Ожирение (часто сопровождающееся инсулинорезистентностью). 5. Сахарный диабет. 6. Гиподинамия. 7. Нерациональное питание.
| ||
| 4.2. Патогенез | ||

| ||
Патогенез атеросклероза чрезвычайно сложен и многие его звенья до сих пор остаются малоизученными или имеют различную интерпретацию. Это объясняет отсутствие в настоящее время единой общепринятой теории патогенеза этого заболевания, которая объединяла бы все известные механизмы его развития. Следует упомянуть о классической липидно-инфильтрационной теории Н.Н. Аничкова (1913) и инфильтративно-комбинационной теории Н.Н. Аничкова и С.С. Халатова (1946). Согласно представлениям этих авторов, в основе возникновения атеросклероза лежит инфильтрация в стенку артерий экзогенного и эндогенного холестерина, что ведет к своеобразной клеточной реакции сосудистой стенки и формированию атеросклеротической бляшки.
По современным представлениям, в основе развития атеросклероза лежит последовательное взаимодействие многих патогенетических факторов, ведущее в конечном счете к образованию фиброзной бляшки (неосложненной и осложненной). Различают три основные стадии формирования атеросклеротической бляшки (атерогенез):
- образование липидных пятен и полосок (стадия липоидоза);
- образование фиброзной бляшки (стадия липосклероза);
- формирование осложненной атеросклеротической бляшки.
| 4.2.1. Образование липидных пятен и полосок |

|
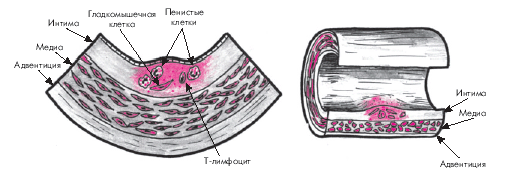
Начальная стадия атеросклероза характеризуется появлением в интиме артерий пятен и полосок, содержащих липиды (рис. 4.8).
|
| Рис. 4.8. Начальная стадия образования атеросклеротической бляшки (формирование липидных пятен и полосок). В интиме присутствуют пенистые клетки, Т-лимфоцит и гладкомышечные клетки. Красными точками обозначены липиды, располагающиеся преимущественно внутри клеток |
Липидные пятна представляют собой небольших размеров (до 1,0–1,5 мм) участки на поверхности аорты или крупных артерий, которые имеют желтоватый цвет. Липидные пятна состоят, главным образом, из пенистых клеток, содержащих большое количество липидов, и Т-лимфоцитов. В меньшем количестве в них присутствуют также макрофаги и гладкомышечные клетки. Со временем липидные пятна увеличиваются в размерах, сливаются друг с другом и образуют так называемые липидные полоски, слегка возвышающиеся над поверхностью эндотелия. Они также состоят из макрофагов, лимфоцитов, гладкомышечных и пенистых клеток, содержащих липиды. На этой стадии развития атеросклероза ХС расположен преимущественно внутриклеточно и лишь небольшое его количество находится вне клеток.
Липидные пятна и полоски образуются в результате отложения липидов в интиме артерий. Первым звеном этого процесса является повреждение эндотелия и возникновение эндотелиальной дисфункции, сопровождающейся повышением проницаемости этого барьера. Причинами первоначального повреждения эндотелия могут служить несколько факторов:
- механическое воздействие на эндотелий турбулентного потока крови, особенно в местах разветвления артерий;
- артериальная гипертензия, увеличивающая напряжение сдвига;
- увеличение в крови атерогенных ЛНП и ЛП (α), особенно их модифицированных форм, образующихся в результате перекисного окисления липидов или их гликозилирования (при сахарном диабете) и обладающих выраженным цитотоксическим действием;
- увеличение активности САС и РАС, сопровождающееся цитотоксическим действием катехоламинов и ангиотензина II на сосудистый эндотелий;
- хроническая гипоксия и гипоксемия любого происхождения;
- курение;
- повышение в крови уровня гомоцистеина, например, при дефиците витамина В6, В12 и фолиевой кислоты;
- вирусная и хламидийная инфекция, сопровождающаяся развитием хронического воспаления в стенке артерии.
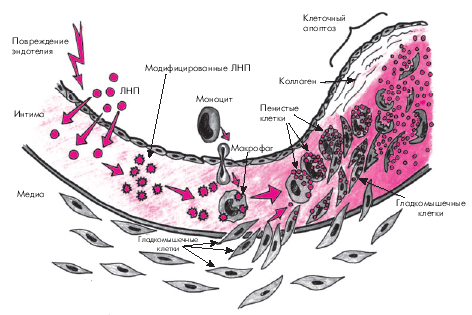
В результате повреждения эндотелия формируется эндотелиальная дисфункция, проявляющаяся снижением продукции вазодилатирующих факторов (простациклин, окись азота и др.) и увеличением образования вазоконстрикторных веществ (эндотелинов, АII, тромбоксана А2 и др.), еще больше повреждающих эндотелий и повышающих его проницаемость. Модифицированные ЛНП, ЛП (α) и некоторые клеточные элементы крови (моноциты, лимфоциты) проникают в интиму артерий и подвергаются окислению или гликозилированию (модификации), что способствует еще большему повреждению эндотелия и облегчает миграцию из кровотока в интиму артерий этих клеточных элементов (рис. 4.9).
|
| Рис. 4.9. Схема начальной стадии атерогенеза. Объяснение в тексте |
Моноциты, проникшие в интиму, трансформируются в макрофаги, которые с помощью так называемых скэвенджер-рецепторов (“рецепторов–мусорщиков”) поглощают модифицированные ЛНП (в меньшей степени — остатки ХМ и ЛОНП) и накапливают свободный и эстерифицированный ХС. Перегруженные липидами макрофаги превращаются в пенистые клетки. Макрофаги, перегруженные модифицированными ЛНП, а также тромбоциты, проникающие в интиму артерий из крови, секретируют факторы роста и митогены, воздействующие на гладкомышечные клетки, расположенные в средней оболочке артерий (медии). Под действием факторов роста и митогенов гладкомышечные клетки мигрируют в интиму и начинают пролиферировать. Находясь в интиме, они захватывают и накапливают модифицированные ЛНП, также превращаясь в своеобразные пенистые клетки. Кроме того, гладкомышечные клетки приобретают способность сами продуцировать элементы соединительной ткани (коллаген, эластин и гликозаминогликаны), которые в дальнейшем используются для построения фиброзного каркаса атеросклеротической бляшки. Со временем пенистые клетки подвергаются апоптозу — запрограммированной гибели клеток и разрушению клеточной оболочки. В результате липиды попадают во внеклеточное пространство.
Описанные процессы лежат в основе первой стадии формирования атеросклеротической бляшки — образования липидных пятен и полосок. По данным А.Н. Климова и Н.Г. Никульчевой (1999), липидные пятна появляются в артериях с раннего детства. Так, уже в первом полугодии жизни они обнаруживаются в некоторых секционных случаях. У детей старшего возраста липоидоз встречается чаще и становится более интенсивным и распространенным. В возрасте 10 лет липидные пятна занимают около 10% поверхности аорты, а к 25 годам — от 30% до 50% поверхности. В венечных артериях сердца липоидоз встречается с 10–15 лет, а в артериях мозга — в конце третьего десятилетия жизни (к 35–45 годам).
| 4.2.2. Образование фиброзной бляшки |

|
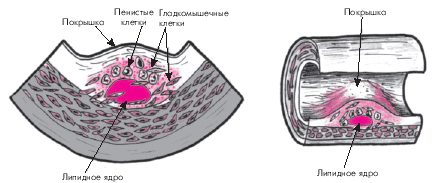
По мере прогрессирования патологического процесса в участках отложения липидов разрастается молодая соединительная ткань, что ведет к образованию фиброзных бляшек, в центре которых формируется так называемое липидное ядро (рис. 4.10). Этому способствует увеличение количества липидов, высвобождающихся в результате гибели (апоптоза) гладкомышечных клеток, макрофагов и пенистых клеток, перегруженных липидами. Экстрацеллюлярно расположенные липиды пропитывают интиму, образуя липидное ядро, которое представляет собой скопление атероматозных масс (липидно-белкового детрита). Вокруг липидного ядра возникает зона соединительной ткани, вначале богатой клеточными элементами (макрофагами, пенистыми и гладкомышечными клетками, Т-лимфоцитами), коллагеном и эластическими волокнами. Одновременно происходит васкуляризация очага атеросклеротического поражения. Вновь образующиеся сосуды отличаются повышенной проницаемостью и склонностью к образованию микротромбов и разрывам сосудистой стенки. По мере созревания соединительной ткани количество клеточных элементов уменьшается, а коллагеновые волокна утолщаются, формируя соединительнотканный каркас атеросклеротической бляшки, который отделяет липидное ядро от просвета сосуда (“покрышка”). Формируется типичная фиброзная бляшка, выступающая в просвет сосуда и нарушающая кровоток в нем (рис. 4.10).
|
| Рис. 4.10. Стадия образования фиброзной бляшки. Объяснение в тексте |
Следует заметить, что клиническое и прогностическое значение сформировавшейся атеросклеротической бляшки во многом зависит именно от структуры ее фиброзной покрышки и размеров липидного ядра. В некоторых случаях, в том числе на относительно ранних стадиях формирования бляшки, ее липидное ядро хорошо выражено, а соединительнотканная капсула сравнительно тонкая и может легко повреждаться под действием высокого АД, ускорения кровотока в артерии и других факторов. Такие мягкие и эластичные бляшки иногда называют “желтыми бляшками” (рис. 4.11, а). Они, как правило, мало суживают просвет сосуда, но ассоциируются с высоким риском возникновения повреждений и разрывов фиброзной капсулы, т.е. с формированием так называемой “осложненной” атеросклеротической бляшки (рис. 4.11, б).
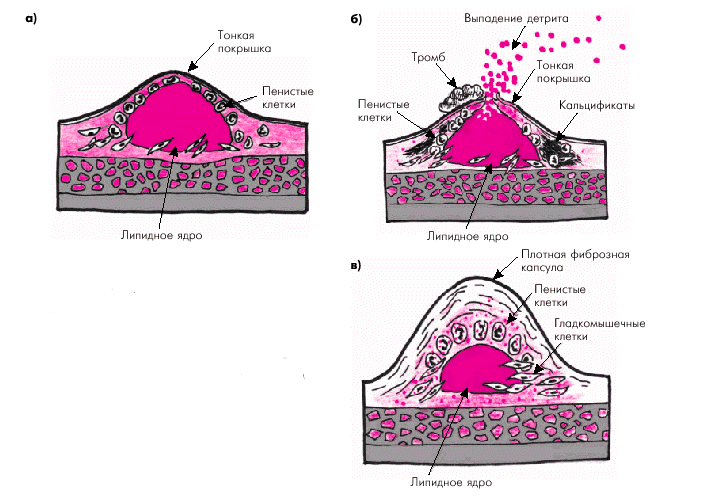
|
| Рис. 4.11. Различия в строении «желтой» (а, б) и «белой» бляшки (в). а — эластичная «желтая» бляшка с большим липидным ядром и тонкой покрышкой; б — разрыв «желтой» бляшки с выпадением детрита в просвет сосуда (красные точки) и образованием пристеночного тромба; в — строение «белой» фиброзной бляшки со сравнительно небольшим липидным ядром и толстой прочной фиброзной капсулой |
В других случаях фиброзная покрышка хорошо выражена, плотная и меньше подвержена повреждению и разрывам. Такие бляшки называют “белыми” (рис. 4.11, в). Они нередко значительно выступают в просвет артерии и вызывают гемодинамически значимое ее сужение, которое в некоторых случаях может осложняться возникновением пристеночного тромба.
| 4.2.3. Формирование «осложненной» бляшки |

|
Прогрессирование атероматозного процесса приводит к формированию “осложненной” атеросклеротической бляшки. Эта стадия атероматоза характеризуется значительным увеличением липидного ядра (до 30% и более от общего объема бляшки), возникновением кровоизлияний в бляшку, истончением ее фиброзной капсулы и разрушением покрышки с образованием трещин, разрывов и атероматозных язв (рис. 4.12). Выпадающий при этом в просвет сосудов детрит может стать источником эмболии, а сама атероматозная язва — служить основой для образования тромбов. Завершающей стадией атеросклероза является атерокальциноз — отложение солей кальция в атероматозные массы, межуточное вещество и фиброзную ткань.
Предполагают, что истончение фиброзной покрышки атеросклеротической бляшки и склонность ее к разрывам связаны с действием протеолитических ферментов — металлопротеиназ (коллагеназы, желатиназы, стромелизина и др.), которые разрушают соединительнотканный каркас бляшки. Кроме того, имеет значение продолжающаяся инфильтрация бляшки макрофагами, что поддерживает активность асептического воспалительного процесса и способствует повреждению ее фиброзной капсулы.
Главным следствием формирования “осложненной” атеросклеротической бляшки является образование пристеночного тромба, который внезапно и резко ограничивает кровоток в артерии. В большинстве случаев именно в этот период возникают клинические проявления обострения заболевания, соответствующие локализации атеросклеротической бляшки (нестабильная стенокардия, инфаркт миокарда, ишемический инсульт и т.п.).
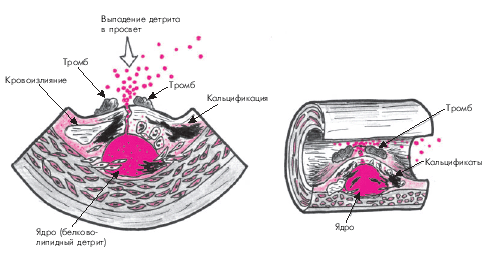
|
| Рис. 4.12. «Осложненная» атеросклеротическая бляшка. Объяснение в тексте |
 Запомните
К числу наиболее значимых осложнений атеросклеротического процесса относятся: 1. Гемодинамически значимое сужение просвета артерии за счет выступающей в просвет артерии атеросклеротической бляшки. 2. Разрушение фиброзной капсулы, ее изъязвление, что способствует агрегации тромбоцитов и возникновению пристеночного тромба. 3. Разрыв фиброзной капсулы атеросклеротической бляшки и выпадение в просвет сосуда содержимого липидного ядра — детрита, который может стать источником эмболии или формирования пристеночного тромба. 4. Кровоизлияние в бляшку из вновь образованных микрососудов, что также способствует разрыву покрышки и формированию тромба на поверхности атеросклеротической бляшки и т.д. 5. Отложение солей кальция в атероматозные массы, межуточное вещество и фиброзную ткань, что существенно увеличивает плотность атеросклеротической бляшки. Запомните
К числу наиболее значимых осложнений атеросклеротического процесса относятся: 1. Гемодинамически значимое сужение просвета артерии за счет выступающей в просвет артерии атеросклеротической бляшки. 2. Разрушение фиброзной капсулы, ее изъязвление, что способствует агрегации тромбоцитов и возникновению пристеночного тромба. 3. Разрыв фиброзной капсулы атеросклеротической бляшки и выпадение в просвет сосуда содержимого липидного ядра — детрита, который может стать источником эмболии или формирования пристеночного тромба. 4. Кровоизлияние в бляшку из вновь образованных микрососудов, что также способствует разрыву покрышки и формированию тромба на поверхности атеросклеротической бляшки и т.д. 5. Отложение солей кальция в атероматозные массы, межуточное вещество и фиброзную ткань, что существенно увеличивает плотность атеросклеротической бляшки.
| ||
| 4.3. Клиническая картина | ||

| ||
Клиническая картина атеросклеротического поражения артерий зависит от преимущественной локализации процесса, а также степени и характера возникающих при этом гемодинамических нарушений. В клинической практике наиболее часто встречаются следующие локализации атеросклероза:
- атеросклероз грудной аорты и ее ветвей;
- атеросклероз брюшной аорты и ее ветвей;
- атеросклероз коронарных артерий (ИБС);
- атеросклероз церебральных сосудов;
- атеросклероз периферических артерий;
- атеросклероз почечных артерий и др.
Наиболее часто в патологический процесс вовлекаются брюшная и грудная аорта, венечные сосуды сердца и церебральные сосуды. Каждый из приведенных вариантов преимущественной локализации атеросклеротических поражений отличается собственной клинической симптоматикой, обусловленной нарушением кровоснабжения и изменением структуры и функции того или иного органа. Например, атеросклероз коронарных артерий проявляется специфической симптоматикой ИБС; поражение брюшной аорты и ее ветвей — клинической картиной абдоминального атеросклероза или перемежающейся хромотой; экстракраниальных сосудов — клиникой ишемической болезни мозга (ИБМ) и т.д. Несмотря на выраженную неравномерность атеросклеротического поражения отдельных сосудистых областей, у большинства больных патологический процесс носит все же более или менее распространенный системный характер и может быть верифицирован с помощью современных инструментальных методов исследования даже при отсутствии явных клинических проявлений атеросклероза.
Дата добавления: 2015-08-04; просмотров: 768;
