Электрический ток в жидкостях
Электролитами принято называть жидкие проводящие среды, в которых протекание электрического тока сопровождается переносом вещества. Носителями свободных зарядов в электролитах являются положительно и отрицательно заряженные ионы. К электролитам относятся многие соединения металлов с металлоидами в расплавленном состоянии, а также некоторые твердые вещества. Однако основными представителями электролитов, широко используемыми в технике, являются водные растворы неорганических кислот, солей и оснований.
Прохождение электрического тока через электролит сопровождается выделением веществ на электродах. Это явление получило название электролиза.
Электрический ток в электролитах представляет собой перемещение ионов обоих знаков в противоположных направлениях. Положительные ионы движутся к отрицательному электроду (катоду), отрицательные ионы – к положительному электроду (аноду). Ионы обоих знаков появляются в водных растворах солей, кислот и щелочей в результате расщепления части нейтральных молекул. Это явление называется электролитической диссоциацией.
Например, хлорид меди CuCl2 диссоциирует в водном растворе на ионы меди и хлора:
CuCl2 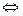 Cu++ + 2Cl–.
Cu++ + 2Cl–.
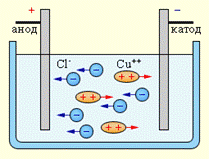
При подключении электродов к источнику тока ионы под действием электрического поля начинают упорядоченное движение: положительные ионы меди движутся к катоду, а отрицательно заряженные ионы хлора – к аноду (рис. 12.10).
|
| Рис. 12.10 |
Достигнув катода, ионы меди нейтрализуются избыточными электронами катода и превращаются в нейтральные атомы, оседающие на катоде. Ионы хлора, достигнув анода, отдают по одному электрону. После этого нейтральные атомы хлора соединяются попарно и образуют молекулы хлора 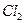 . Хлор выделяется на аноде в виде пузырьков.
. Хлор выделяется на аноде в виде пузырьков.
Закон электролиза был экспериментально установлен английским физиком М. Фарадеем в 1833 году. Первый закон Фарадея определяет количества первичных продуктов, выделяющихся на электродах при электролизе:
масса m вещества, выделившегося на электроде, прямо пропорциональна заряду q, прошедшему через электролит:
m=kq=kIt, (12.30)
где k - электрохимический эквивалент вещества:
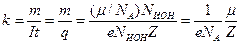 .
.
Здесь μ- молярная масса вещества, NA- число Авогадро, 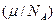 - масса одного иона,
- масса одного иона, 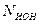 - число выделившихся ионов,
- число выделившихся ионов, 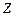 - валентность вещества.
- валентность вещества.
Валентность–этоспособность атома химического элемента образовывать химические связи с другими атомами. Она равна количеству электронов на внешней оболочке атома, способных объединяться с электронами других атомов.
Второй закон Фарадея: электрохимический эквивалент вещества k пропорционален химическому эквиваленту:
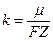 , (12.31)
, (12.31)
F=eNA=9,65∙104 Кл/моль(12.32)
– постоянная Фарадея.
Удельная проводимость 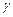 ионизированной трубки с заряженными ионами
ионизированной трубки с заряженными ионами
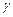
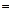
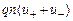 , (12.33)
, (12.33)
где 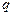 - заряд иона,
- заряд иона, 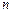 - концентрация ионов в единице объема,
- концентрация ионов в единице объема, 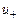 и
и 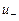 - подвижности положительных и отрицательных ионов.
- подвижности положительных и отрицательных ионов.
Дата добавления: 2015-08-04; просмотров: 1173;
