Прямая кондуктометрия основана на зависимости электропроводности от концентрации.
1. Готовят серию стандартных растворов.
2. Замеряют их электропроводность.
3.
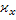
|
g w:val="EN-US"/></w:rPr><m:t>c</m:t></m:r></m:e><m:sub><m:r><w:rPr><w:rFonts w:ascii="Cambria Math" w:h-ansi="Cambria Math"/><wx:font wx:val="Cambria Math"/><w:i/><w:lang w:val="EN-US"/></w:rPr><m:t>x</m:t></m:r></m:sub></m:sSub></m:oMath></m:oMathPara></w:p><w:sectPr wsp:rsidR="00000000"><w:pgSz w:w="12240" w:h="15840"/><w:pgMar w:top="1134" w:right="850" w:bottom="1134" w:left="1701" w:header="720" w:footer="720" w:gutter="0"/><w:cols w:space="720"/></w:sectPr></w:body></w:wordDocument>"> 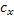
|
| с |
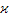
|
Строят график
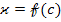 .
.
4. Замеряют удельную электропроводность исследуемого раствора и по графику находят его концентрацию.
Недостатки метода:
1. Электропроводимость – величина аддитивная, а, следовательно, на неё сильно влияют примеси.
2. Зависимость 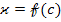 имеет сложный характер и не всегда прямо пропорциональна.
имеет сложный характер и не всегда прямо пропорциональна.
4.
На практике более широко используется кондуктометрическое титрование, где точку эквивалентности определяют по изменению электропроводности раствора. При добавлении одного вещества к другому в результате химической реакции ионный состав раствора меняется, при этом меняется его электропроводность.
Дата добавления: 2015-08-04; просмотров: 1257;
