Электропроводность раствора прямопропорциональна концентрации ионов в растворе и их подвижности.
Электропроводность – величина аддитивная, то есть равна сумме произведений концентраций отдельных ионов на их подвижности.
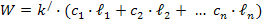
Пример: раствор NaCl c примесью KCl
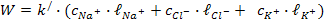
В практике обычно используют удельную электропроводность ( 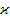 ).
).
Удельная электропроводность – это электропроводность раствора, заключенного между платиновыми электродами поверхностью 1м2 на расстоянии 1м.
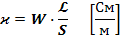
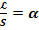 - называется постоянной ячейки и является основной характеристикой сосуда для измерения электропроводности.
- называется постоянной ячейки и является основной характеристикой сосуда для измерения электропроводности.
Постоянная ячейки определяется опытным путем по растворам KCl c известной концентрацией.
Пример: t = 18 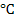
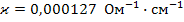 для
для 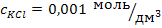
Замеряем на приборе сопротивление этого раствора (R).
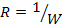
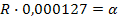
Удельная электропроводность раствора зависит от температуры. При повышении температуры на 1 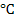 - электропроводность увеличивается на 2%.
- электропроводность увеличивается на 2%.
С , 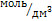
|
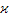
|
Зависимость
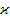 от концентрации выражается графически:
от концентрации выражается графически:
1 – сильные электролиты
2 – средние электролиты
3 – слабые электролиты
Чем больше концентрация ионов и их скорость движения, тем выше электропроводность.
Однако когда концентрация раствора становиться достаточно большой, степень диссоциации падает и возрастает влияние взаимного притяжения, особенно для сильных электролитов. В таком случае удельная электропроводность будет падать.
Для теоретических расчетов используют эквивалентную электропроводность ( 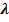 ) – это удельная электропроводность, отнесенная к нормальной концентрации раствора.
) – это удельная электропроводность, отнесенная к нормальной концентрации раствора.
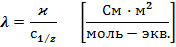
Дата добавления: 2015-08-04; просмотров: 1403;
