Обмен белков.
1. БЕЛКОВОЕ ПИТАНИЕ.
2. ПРЕВРАЩЕНИЕ БЕЛКОВ В ОРГАНАХ ПИЩЕВАРЕНИЯ.
3. ГНИЕНИЕ БЕЛКОВ. ОБРАЗОВАНИЕ ТОКСИЧЕСКИХ ПРОДУКТОВ И МЕХАНИЗМ ИХ
4. ОБЕЗВРЕЖИВАНИЯ.
В нашем организме идёт постоянный синтез и распад белков. Ежесуточно распадается 400гр, белка и столько же синтезируется. Из общей массы организма белка приходится 15кг. Синтез обновленного белка происходит из аминокислот, которые образуются при распаде.
Все АК можно разделить на 4 группы:
1.Заменимые - синтезируются в организме; АЛА, АСП, АСН, ГЛУ. ГЛН, ГЛИ, ПРО. СЕР.
2.Незаменимые - не синтезируются в организме и поступают с пищей: ВАЛ, ЛЕЙ, ИЛЕ. ЛИЗ, ТРЕ, МЕТ, ФЕН, ТРИ.
3.Частично заменимые - синтезируются в организме, но очень медленно и не покрывают всех потребностей организма: ГИС, АРГ.
4.Условно заменимые - синтезируются из незаменимых аминокислот: ЦИС (МЕТ), ТИР (ФЕН).
Полноценность белкового питания определяется:
· Наличием всех незаменимых аминокислот. Отсутствие даже одной незаменимой аминокислоты нарушает биосинтез белка, т.е. каждая незаменимая АК может быть лимитирующей в процессе синтеза белка.
· АМИНОКИСЛОТНЫМ составом белка. Вес АК могут содержаться в продуктах как животного, так
и растительного происхождения. Суточная потребность человека в белках составляет 100гр.
Пищевые белки подвергаются гидролитическому расщеплению под действием целой группы ферментов ПРОТЕОЛИТИЧЕСКИХ ФЕРМЕНТОВ (ПЕПТИДАЗЫ). Большинство этих ферментов вырабатывается в неактивной форме, т.е. в форме ПРОФЕРМЕНТОВ, а затем активируется путём ЧАСТИЧНОГО ПРОТЕОЛИЗА. Это предохраняет стенки органов ЖКТ от самопереваривания. Поверхность желудка и кишечника покрыта слизью, в составе которой содержаться ГЕТЕРОПОЛИСАХАРИДЫ. Они не подвергаются действию ферментов.
Проферменты вырабатываются слизистой желудка или кишечника и поступают в полость этих органов, где происходит их активация. В пристеночном слое вырабатываются БИКАРБОНАТЫ, которые создают среду близкую к нейтральной (рН-=5-6).
В ротовой полости белки не подвергаются каким-либо химическим превращениям, т.к. здесь отсутствуют ферменты, действующие на белки. Здесь происходит лишь механическая переработка пищи.
В желудке начинается химическое превращение белков. Здесь действуют два основных фермента - ПЕПСИН и ГАСТРИКСИН.
ПЕПСИН вырабатывается главными клетками слизистой желудка в неактивной форме - ПЕПСИНОГЕН, который под действием соляной кислоты активируется и превращается в пепсин. Процесс активации является АУТОКАТАЛИТИЧЕСКИМ. ПЁПСИНОГЕН активируется очень медленно, а пепсин потом становится активатором молекул ПЕПСИНОГЕНА. От ПЕПТИДНОЙ цепи неактивного ПЕПСИНОГЕНА со стороны N-конца отрывается один ПЕПТИД, содержащий 42 аминокислоты - активация путём ЧАСТИЧНОГО ПРОТЕОЛИЗА. Затем из остатка цепи формируется когтя трёхмерная структура фермента пепсина и новый активный центр.
Соляная кислота вырабатывается обкладочными клетками слизистой желудка и играет очень важную роль в переваривании белков:
· активирует ПЕПСИНОГЕН, превращая его в пепсин, создаёт оптимум рН для действия пепсина (1,5 - 2),
· обладает бактерицидным действием.
· денатурирует белки, которые потом гидролизуются. Внутренние ПЕПТИДНЫЕ связи становятся доступными для действия пепсина.
· способствует продвижению желудочного содержимого далее в кишечник. Пепсин - это фермент, который является ЭНДОПЕПТИДАЗОЙ, т.е. действует на внутренние ПЕПТИДНЫЕ связи, в образовании которых участвуют ароматические аминокислоты (ФЕН, ТИР, ТРИ) своими АМИДНЫМИ группами.
ГАСТРИКСИН по действию аналогичен пепсину. Это тоже ЭНДОПЕПТИДАЗА. Его оптимум рН = 3 - 3,5. Действует на ПЕПТИДНЫЕ связи, в образовании которых участвуют ДИКАРБОНОВЫЕ аминокислоты (ГЛУ, АСП) своими КАРБОКСИЛЬНЫМИ группами. В желудке под действием ПЕПСИНА и ГАСТРИКСИНА сложные белковые молекулы распадаются на высокомолекулярные ПОЛИПЕПТИДЫ. Ими являются так называемые АЛЬБУМОЗЫ, ПЕПТОНЫ, которые поступают в тонкий кишечник.
В тонком кишечнике эти ПОЛИПЕПТИДЫ подвергаются действию целого ряда протеолитических ферментов ПЖЖ, которые вырабатываются в неактивной форме: ТРИПСИНОГЕН, ХИМОТРИПСИНОГЕН, ПРОЭЛАСТАЗА, ПРОКАРБОКСИПЕПТИДАЗА.
Механизм активации всех этих ферментов - ЧАСТИЧНЫЙ ПРОТЕОЛИЗ по каскадному механизму.
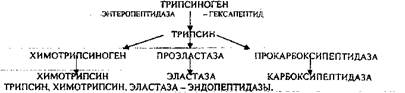
ТРИПСИН разрушает внутренние ПЕПТИДНЫЕ связи, в образовании которых принимают участие ЛИЗ и АРГ.
ХИМОТРИПСИН разрушает внутренние связи, в образовании которых принимают участие ароматические аминокислоты (ТИР, ТРИ, ФРН)
ЭЛАСТАЗА разрушает внутренние ПЕПТИДНЫЕ связи, в образовании которых принимают участие АЛА, ГЛИ, ПРО, ЦИС.
В результате действия ПЕПСИНА, ХИМОТРИПСИНА и ЭЛАСТАЗЫ высокомолекулярные ПЕПТИДЫ расщепляются до низкомолекулярных, которые подвергаются действию ЭКЗОПЕПТИДАЗ, действующих на крайние связи, отщепляя отдельные концевые аминокислоты.
КАРБОКСИПЕПТИДАЗА разрушает крайние связи, отщепляя аминокислоты с С-конца.
АМИНОПЕПТИДАЗА действует на крайние ПЕПТИДНЫЕ связи со стороны N-конца, отщепляя отдельные аминокислоты.
ДИПЕПТИДЫ подвергаются действию ДИПЕПТИДАЗ, продуцирующихся слизистой кишечника сразу в активной форме. Т.о. в результате действия всей этой группы ферментов в ЖКТ белки пищи расщепляются до аминокислот. Образующиеся аминокислоты всасываются стенкой кишечника в кровь и поступают во все органы и ткани.
Не всосавшиеся аминокислоты поступают в толстую кишку, где подвергаются процессам гниения. Это процесс бактериального распада веществ под действием микрофлоры иди ферментов, вырабатывающихся этой микрофлорой, В норме в толстой кишке подвергаются аминокислоты, а при патологии - белки. Это происходит и в других отделах ЖКТ: в желудке (при понижении кислотности), ротовой полости (при кариесе).
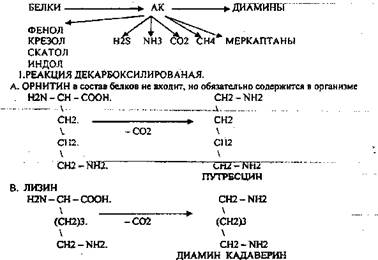
ПУТРЕСЦИН и КАДАВЕРИН являются токсическими веществами. Они входят в состав трупных ядов. 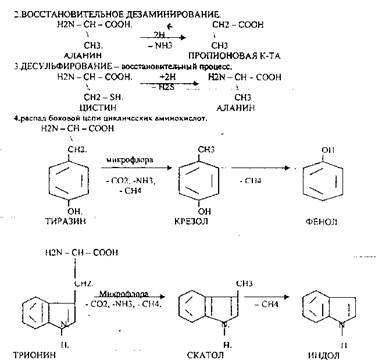
Все эти вещества токсические, образующиеся при гниении поступают в печень, где и происходит их обезвреживание. В печени имеется две системы, участвующие в обезвреживании этих веществ:
УДФГК - УРИДИНДИФОСФОГЛЮКУРОНОВАЯ К-ТА.
ФАФС - ФОСФОАДЕНОЗИНФОСФОСУЛЬФАТ.
Процесс обезвреживания — это процесс конъюгации токсических веществ с одной из этих систем и образование коньюгатов, которые являются уже нетоксическими веществами.
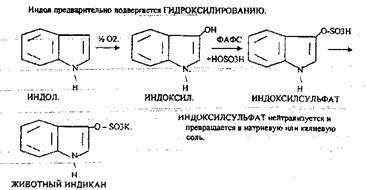
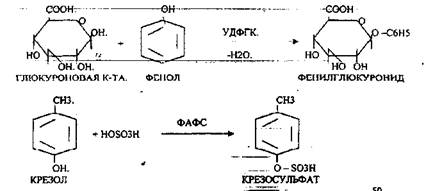
Все эти вещества выводятся из организма с мочой. В норме реакция на индол должна быть Отрицательна. При положительной реакции на индол - нарушена детоксикационная функция печени. Положительная реакция на ИНДИКАН наблюдается при очень активном гниении белков в толстом кишечнике.
1. ИСТОЧНИКИ АМИНОКИСЛОТ В КЛЕТКЕ И ПУТИ ИХ ИСПОЛЬЗОВАНИЯ.
2. МЕТАБОЛИЗМ АМИНОКИСЛОТ.
3. ОБРАЗОВАНИЕ АММИАКА И ПУТИ ЕГО ОБЕЗВРЕЖИВАНИЯ. СИНТЕЗ МОЧЕВИНЫ.
Источниками аминокислот в клетке являются:
1. белки пищи после их гидролиза в органах пищеварения,
2. синтез заменимых аминокислот.
3. распад тканевых белков.
Тканевые белки подвергаются гидролитическому расщеплению при участии тканевых ПРОТЕАЗ - КАТЕПСИНОВ, которые в основном находятся в ЛИЗОСОМАХ, но могут быть и в МИТОХОНДРИЯХ и ЭПС
Эти ферменты обладают специфичностью действия. Выделяют разные КАТЕПСИНЫ, которые отличаются оптимумом рН и специфичностью действия на ПЕПТИДНЫЕ СВЯЗИ. Распад тканевых белков необходим для обновления белков, а также для устранения дефектных молекул белка.

Часть аминокислот в тканях подвергается различным метаболическим превращениям.
1. Основной путь превращения аминокислот в тканях - это реакции ПЕРЕАМИНИРОВАНИЯ реакции между АМИНО- и КЕТОКИСЛОТАМИ, когда они обмениваются своими функциональными группами, при этом аминокислоты являются донорами аминогрупп, а кетокислоты - их акцепторами. Эти реакции катализирует фермент - АМИНОТРАНСФЕРАЗА. Она локализуется в МИТОХОНДРИЯХ и ЦИТОПЛАЗМЕ. ТРАНСАМИНИРОВАНИЮ могут подвергаться все аминокислоты кроме ЛИЗ и ТРЕ. В организме человека обнаружено 10 различных АМИНОТРАНСФЕРАЗ. Наибольшее значение имеют АТ, донорами аминогрупп которых являются АЛА, АСП, ГЛУ, ГЛУТАМИНОВАЯ кислота является универсальным донором., а альфа —КГК — универсальным акцептором аминогрупп.
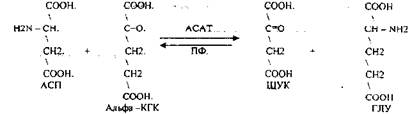
Роль реакций ТРАНСАМИНИРОВАНИЯ:
1. используются для синтеза заменимых аминокислот. При этом происходит перераспределение
азота в органах и тканях.
2. Является начальным этапом катаболизма аминокислот
3. В результате ТРАНСАМИНИРОВАНИЯ образуются альфа-КЕТОКИСЛОТЫ, которые поступают в ЦТК и включаются в ГЛЮКОНЕОГЕНЕЗ.
4. Протекают в разных тканях, но более всего в печени.
Определение активности АТ имеет диагностическое значение в клинике.
АСАТ наиболее активна в миокарде, следовательно, повышение в сыворотке крови АСАТ можно предположить патологию в сердечной мышце.
АЛАТ (АЛАНИНОВАЯ АТ) особенно активна в печени, следовательно, повышение её в сыворотке крови свидетельствует о деструктивных изменениях в печени.
При избытке АЛАНИНА или недостатке АСПАРАГИНОВОЙ К-ТЫ;
2. Реакции ДЕКАРБОКСИЛИРОВАНИЯ - разрушение СООН-группы с выделением СО2, При этом аминокислоты в тканях образуют биогенные амины, которые являются биологически активными веществами (БАВ). Среди них могут быть соединения, которые выполняют функции:
· НЕЙРОМЕДИАТОРОВ (СЕРЕТОНИМ, ДОФАМИН, ГАМК),
· Гормоны (АДРЕНАЛИН, НОРАДРЕНАЛИН),
· Регуляторы местного действия (ГИСТАМИН).
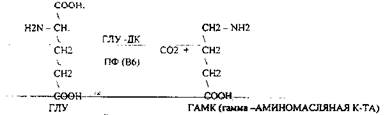
ГАМК является НЕЙРОМЕДИАТОРОМ тормозного действия, поэтому препараты на основе ГАМК используются в клинике для лечения некоторых заболеваний ЦНС. Эта реакция используется в педиатрической практике: детям при сильном возбуждении используют раствор витамина В6, который стимулирует процесс образования ГАМК.
ДОФАМИН является НЕЙРОМЕДИАТОРОМ возбуждающего действия. Он является основой для синтеза АДРЕНАЛИНА и НОРАДРЕНАЛИНА
. 
2.Реакции ДЕЗАМИНИРОВАНИЯ - разрушение NН2-группы с выделением аммиака. В организме возможны следующие виды ДЕЗАМИНИРОВАНИЯ.
1. Восстановительное
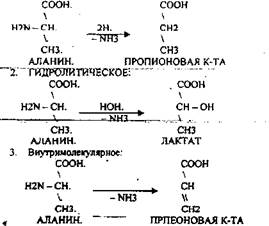
Эти три вида ДЕЗАМИНИРОВАНИЯ имеют место при гниении, т.е. идут в толстой кишке.
4. Окислительное. Протекает в клетке. Непосредственно, ОКИСЛИТЕЛЬНОМУ ДЕЗАМИНИРОВАНИЮ подвергается только ГЛУ.
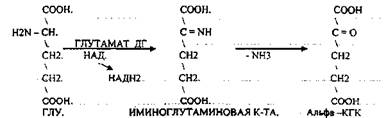
ОКИСЛИТЕЛЬНОМУ ДЕЗАМИНИРОВАНИЮ подвергаются и другие аминокислоты, но этот путь является непрямым. Он идёт через ГЛУ и называется процессом НЕПРЯМОГО ОКИСЛИТЕЛЬНОГО ДЕЗАМИНИРОВАНИЯ.
Аммиак образуется из аминокислот при распаде других азотсодержащих соединений (биогенных аминов, НУКЛЕОТИДОВ), Значительная часть аммиака образуется в толстой кишке при гниении. Он всасывается в кровь системы воротной вены, здесь концентрация аммиака больше, чем в общем кровотоке.
Аммиак образуется в различных тканях. Концентрация его в крови незначительна, т.к. он является токсичным веществом (0,4 — 0,7мг/л). Особенно выраженное токсическое действие он оказывает на нервные клетки, поэтому значительное его повышение приводит к серьёзным нарушениям обменных процессов в нервной ткани.
ПУТИ ОБЕЗВРЕЖИВАНИЯ АММИАКА
1. образование АМИДОВ

ГЛУТАМИН и АСПАРАГИН - нетоксические вещества. Их называют транспортной формой аммиака в организме. Они не проникают через мембраны и в почках распадаются до аминокислот и аммиака.
2. Восстановительное АМИНИРОВАНИЕ. 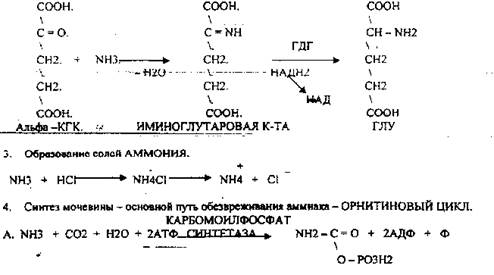
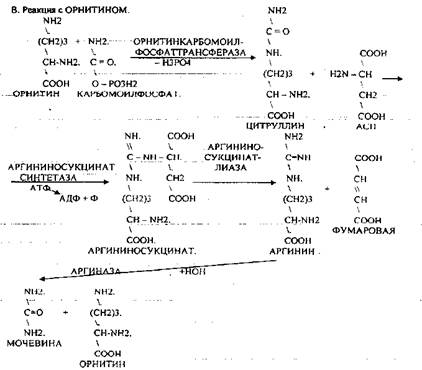
АРГИНАЗА обладает абсолютной специфичностью и содержится только в печени. В составе мочевины содержится два атома азота один поступает из аммиака, а другой выводится из АСП.
Образование мочевины идёт только в печени.
Две первые реакции цикла (образование ЦИТРУЛЛИНА и АРГИНИНОСУКЦИНАТА) идут в
МИТОХОНДРИЯХ, остальные в цитоплазме. В организме в сутки образуется 25гр мочевины. Этот показатель характеризует мочевино-образующую функцию печени. Мочевина из печени поступает в почки, где и выводится из организма, как конечный продукт азотистого обмена.
Дата добавления: 2015-08-04; просмотров: 1723;
