КЛАССЫ ЧИСТОТЫ ПРОИЗВОДСТВЕННЫХ ПОМЕЩЕНИЙ
GMP (правила надлежащего производства) - это единая система требований по организации производства и контролю качества лекарственных средств от начала переработки сырья до производства готовых продуктов, включая общие требования к помещениям, оборудования и персоналу. В России данную функцию выполняет руководящий нормативный документ РД 64-125-91 "Правила организации производства и контроля качества лекарственных средств", утвержденный приказом Министра медицинской промышленности СССР в 1992 г.Согласно данному документу все помещения для производства лекарств в асептических условиях делятся на 4 класса в зависимости от чистоты воздуха.
1-й класс чистотыдостигается установкой в помещении 2-го класса "чистых" камер с подачей ламинарного потокачистого стерильного воздуха. В помещениях 1-го класса выполняются наиболее ответственные технологические операции: выгрузка стерильных флаконов, пробок, колпачков, разлив стерильного раствора, фасовка стерильных порошков, предукупорка и укупорка флаконов пробками, сборка стерилизующих фильтров, отбор проб.
2-й и 3-й классы чистотыобеспечиваются за счет технологических и санитарных мероприятий, стерильной приточной вентиляции, рециркуляционных очистителей воздуха, увеличением кратности воздухообмена, специальной подготовки помещений и персонала. В помещениях 2-го касса чистоты производится изготовление растворов, фильтрование, мойка ампул и флаконов, их сушка и стерилизация. Помещения 3-го класса используются для мойки и стерилизации вспомогательного материала.
В помещениях 4-го класса осуществляется мойка дрота, выделка ампул и т.д.
Основные требования GMPк производству инъекционных лекарственных форм заключаются в следующем:
♦ в работе участвуют минимальное количество людей:
♦ активность человека должна быть сведена к минимуму, чтобы избежать изменения перемещения частиц и микроорганизмов;
♦ одежда должна соответствовать процессу и рабочему месту и предохранять продукт от загрязнения;
♦ исходный материал не должен быть обсеменен микроорганизмами и пирогенными веществами;
♦ хранение воды, используемой для изготовления инъекционных растворов, осуществляется при постоянной циркуляции и температуре выше 80 °С;
♦ предохранение лекарственной формы перед стерилизацией для предупреждения кантаминации (повторного обсеменения) микроорганизмами;
♦ интервал между изготовлением и стерилизацией должен быть минимальным;
♦ каждый цикл стерилизации контролируется биологическими и химическими способами;
♦ пробы раствора, взятые на анализ для определения стерильности, должны включать пробы в начале и в конце работы,
пробы после значительного перерыва в работе и пробы из потенциально наиболее холодной части загрузки автоклава,
♦ на пирогенность контролируется вода, промежуточные и конечные продукты,
♦ помещения должны иметь многоступенчатую систему приточно-вытяжной вентиляции.
♦ между помещениями различных классов чистоты должна поддерживаться разность давления, причем давление в помещениях более высокого класса чистоты должно быть выше;
♦ ответственные операции должны быть защищены установками ламинарного потока стерильного воздуха (движение параллельных потоков стерильного воздуха внутри ограниченного пространства):
♦ санитарно-бытовые помещения должны примыкать к производственным;
♦ вход персонала и передача материала в производственные помещения должны осуществляться через воздухошлюзы:
♦ для облегчения уборки и обработки дез. растворами сопряжения между стенами, полом и потолком должны быть закругленной формы;
♦ между помещениями различных классов чистота должны быть переговорные устройства;
♦ запрещается применение фильтров, выделяющих волокна и др. ТЕХНОЛОГИЧЕСКАЯ СХЕМА ПОЛУЧЕНИЯ РАСТВОРА РИНГЕРА_ЛОККА
1 получение ампул (флаконов) 2 Подготовка сосудов к наполнению 2.1. Мойка наружной поверхности сосудов2.2. Мойка сосудов изнутри
2.3. Контроль качества мойки
2.4. Сушка и стерилизация сосудов
3. Получение и подготовка растворителя
4. Подготовка лекарственных веществ 5 Изготовление раствора
5.1. Растворение лекарственного вещества
5.2. Стандартизация
5.3. Очистка (фильтрование)
6. Заполнение сосудов
7. Укупорка флаконов
8. Стерилизация
8. Оценка качества продукции и брокераж 10. Маркировка и упаковка
Методы контроля качества инъекционных растворов
Во время технологического процесса производства инъекционных растворов обязательно проводят промежуточный (постадийный) контроль качества, т. е. после каждой технологической стадии или операции проводится бракераж флаконов, гибких контейнеров, не отвечающих определенным требованиям. Так, после растворения лекарственного вещества, контролируется качественный и количественный состав, рН раствора, плотность и др.; после операции наполнения — проверяется выборочно объем наполнения сосудов.
Определение норм наполнения. Фактический объем наполнения сосудов должен быть больше номинального. ГФ XI издания устанавливает нормы налива и количества сосудов для контроля. В сосудах вместимостью до 50 мл наполнение проверяют калиброванным шприцем, в сосудах вместимостью 50 мл и более — калиброванным цилиндром при температуре 20±2 °С. Таблица норм наполнения ампул растворами приведена выше.
Определение герметичности. Контроль качества укупорки проходят 100% сосудов и для определения герметичности используют 3 метода:
— вакуумирование;
— с помощью растворов индикаторов (для водных растворов) и воды или мыльного раствора (для масляных растворов);
— по свечению газовой среды внутри сосуда под действием высокочастотного электрического поля.
Контроль на механические включения. Проводят путем просмотра сосудов на черном и белом фоне при освещении 60 Вт. На черном фоне проверяются прозрачность и наличие механических включений — стеклянная пыль, волокна фильтрующих материалов, нерастворенные частицы лекарственного вещества и т. д.: на белом — цветность раствора, отсутствие механических включений черного цвета и целостность стеклянного изделия. Метод имеет недостатки: субъективизм контролера — острота зрения, опыт работы, усталость и т. д. Допустимая ошибка метода составляет 30%.
Для более объективной оценки качества раствора по этому параметру были разработаны другие методы:
— визуально-оптические, основанные на использовании проекторов, увеличительных линз, поляризационного света и т. д.;
— оптические, с автоматической регистрацией фотоэлементами поглощения или рассеивания проходящего света;
— мембранно-микроскопические;
— проточные методы.Количественное содержание лекарственных веществ, входящих в состав инъекционных растворов, определяют согласно указаниям ФС или другой нормативно-технической документации. Определение количественного состава проводится на каждой серии раствора.
Определение стерильности растворов проводится путем посева и инкубации на специальных тест-средах образцов каждой серии продукции. При обнаружении роста микроорганизмов хотя бы в одной пробирке испытание повторяют на таком же количестве сосудов. И только при отсутствии роста при повторном посеве серия считается стерильной. Определению стерильности подвергают ампулы или флаконы каждой серии, одновременно подвергавшиеся стерилизации в одном стерилизующем аппарате.
Метод мембранного фильтрования при определении стерильности рекомендован при выраженном антимикробном действии лекарственного вещества и испытании растворов в больших объемах (более 100 мл). Отбирается 30 ампул, их делят на 3 группы по 10 штук, 20 используют для испытания на стерильность, 10 — для контроля полноты отмывания мембраны от лекарственного вещества. Для фильтрования применяют установку с мембраной диаметром 47 мм и размером пор 0,45±0,02 мкм. Фильтры стерилизуют при температуре 121±1 °С 20 мин. Если испытывают порошок, его растворяют в воде для инъекций, фильтруют через стерильную мембрану, которую промывают от раствора 3—5 порциями растворителя по 100 мл, разрезают стерильными ножницами на 2 части, одну из них помещают в колбу с тиогликолевой средой, вторую — в среду Сабуро, 7 дней инкубируют при ежедневном просмотре. Все операции проводят в асептических условиях. При отсутствии роста на двух средах делают заключение о стерильности серии.
Определение пирогенности растворов проводят биологическим методом согласно ГФ XI издания. За рубежом широко применяют лимулус-тест (лим-тест), основанный на образовании геля при взаимодействии бактериальных пирогенов с лизатом амебоцитов крови крабов Liraulus polyphemus. В России разработан аналогичный метод, основанный на способности грамотрицательных микроорганизмов (основные продуценты пирогенных веществ) образовывать гель в 3% растворе калия гидроксида.
Методы стерилизации
По требованиям Государственной фармакопеи XI издания все готовые лекарственные препараты должны выдерживать тест на микробиологическую чистоту. Поэтому процесс стерилизации имеет большое значение при изготовлении всех лекарственных форм, а особенно инъекционных.
Под стерилизацией (обеззараживание, обеспложивание) понимают совокупность физических, химических и механических способов освобождения от вегетативных и покоящихся форм микроорганизмов (Н. Horn, 1984).
ГФ XI издания определяет стерилизацию как процесс умерщвления в объекте или удаления из него микроорганизмов всех видов, находящихся на всех стадиях развития.
Поскольку к производству стерильных лекарственных форм предъявляют высокие требования по микробиологической чистоте (надежность стерильных инъекционных препаратов должна быть не ниже 10" ), то обеспложиванию подвергаются не только готовый продукт, но и используемое оборудование, вспомогательные материалы, фильтры, растворители, исходные вещества. Выбор того или иного способа стерилизации должен основываться на экономических соображениях и технологичности обработки, включая возможность ее автоматизации. От правильно подобранного метода стерилизации зависит качество производимой стерильной продукции.
В технологии лекарственных форм промышленного производства в настоящее время используют 3 группы методов стерилизации:
— механические;
— химические;
— физические.
Механические методы стерилизацииСтерилизующая фильтрация. Микробные клетки и споры можно рассматривать как нерастворимые образования с очень малым (1—2 мкм) размером частиц. Подобно другим выключениям, они могут быть отделены от жидкости механическим путем — фильтрованием сквозь мелкопористые фильтры. Этот метод стерилизации включен в ГФ XI для стерилизации терм о лабильных растворов.
По механизму действия фильтрующие перегородки, используемые для стерильной фильтрации, подразделяют-на глубинные и поверхностные (мембранные) с размером пор не более 0,3 мкм.
Глубинные фильтры характеризуются сложным механизмом задержания микроорганизмов (ситовым, адсорбционным, инерционным). Ввиду большой толщины таких фильтров удерживаются и частицы меньшего размера, чем размер пор фильтрующей перегородки.
Глубинные фильтры классифицируют на; керамические и фарфоровые {размер пор 3—4 мкм), стеклянные (около 2 мкм), бумажно-асбестовые (1—1,8 мкм). Недостатками керамических и фарфоровых фильтров является продолжительность стерилизации, потеря раствора в порах толстого фильтра, образование микротрещин из-за хрупкости материала и. следовательно, ненадежность стерилизации.
Так, стеклянные и бумажно-асбестовые фильтры несовершенны. Стеклянные фильтры малопроизводительны, бумажно-асбестовые фильтры не рекомендуются для стерилизации инъекционных растворов, поскольку они состоят из волокнистых материалов и имеется угроза отрыва волокон от фильтра. Попадая в организм с раствором, такие волокна могут вызывать различные патологические реакции.
В последние годы большое распространение для стерилизующей фильтрации получили микропористые мембранные фильтры. Они лишены недостатков, присущих стеклянным и бумажно-асбестовым фильтрам.
Мембранные фильтры представляют собой тонкие (100— 150 мкм) пластины из полимерных материалов, характеризующиеся ситовым механизмом задержания микроорганизмов и постоянным размером пор (около 0.3 мкм). Во избежание быстрого засорения фильтра мембраны используют в сочетании с префильтрами. имеющими более крупные поры. При стерилизации больших объемов растворов оптимальным является применение фильтров обоих типов.
Использование глубинных и мембранных фильтров обеспечивает необходимую чистоту, стерильность и апирогенность растворов для инъекций.
Стерилизующая фильтрация имеет преимущества по сравнению с методами термической стерилизации. Для многих растворов термолабильных веществ (апоморфина гидрохлорид, викасол, барбитал натрия и другие) его признают единственно доступным методом стерилизации. Метод весьма перспективный в производстве глазных капель.
Химические методы стерилизации
Методы основаны на высокой специфической (избирательной) чувствительности микроорганизмов к различным химическим веществам, что обусловливается физико-химической структурой их клеточной оболочки и протоплазмы. Механизм антимикробного действия многих таких веществ еще недостаточно изучен. Считают, что некоторые вещества вызывают коагуляцию протоплазмы клетки, другие — действуют как окислители. Ряд веществ влияет на осмотические свойства клетки, многие химические факторы вызывают гибель микробиологической клетки благодаря разрушению ферментной системы. Основа любого варианта химической стерилизации — взаимодействие бактерицидного вещества с компонентами микробной клетки или споры.
Химическая стерилизация подразделяется на стерилизацию растворами (веществами) и стерилизацию газами (газовая стерилизация).
Стерилизация растворами или веществами. Стерилизацию растворами (веществами) серийно выпускаемой инъекционной продукции в заводских условиях не используют, таккак введение в раствор постороннего биологически активного вещества нежелательно из-за возможных химического взаимодействия стерилизующего агента с действующими компонентами и побочных действий этого агента на организм человека. Еще одно принципиальное ограничение данного метода связано с тем. что практически любое бактерицидное вещество обладает определенной селективностью и его эффективность проявляется при высоких концентрациях или часто в определенных интервалах рН, недопустимых для живых организмов. Этот вид стерилизации используют для обеззараживания различной аппаратуры, трубопроводов и другого оборудования, применяемого в производстве стерильной продукции.
Газовая стерилизация. К своеобразной химической стерилизации следует отнести метод стерилизации газами. Преимущество метода — возможность стерилизации объектов в пластмассовой упаковке, проницаемой для газов. В герметическую камеру вводят стерилизант — смесь этиленоксида и углерода диоксида в соотношении 9:1. Углекислый газ добавляют в связи со взрывоопасностью окиси этилена. При стерилизации стерилизант поступает в аппарат под давлением до 2 кгс/см2 (196133 Н/м ) при температуре 43—45 °С. Продолжительность стерилизации зависит от проницаемости упаковки, толщины слоя материала и продолжается от 4 до 20 ч. Затем этиленоксид удаляют продуванием стерильным воздухом (азотом) или путем вакуумирования.
При химической стерилизации газами погибают все вегетативные формы микроорганизмов и плесневые грибы.
Для стерилизации донорского материала, растворов кровезаменителей или продуктов, полученных из крови, широко применяют б-пропиолактон.
Главный недостаток, химических методов стерилизации — необходимость освобождения простерилизованного объекта от остатков стерилизанта и продуктов возможного взаимодействия. Широкое распространение метода затруднительно из-за длительности стерилизации, высокой стоимости, возможности побочного действия химического агента на обслуживающий персонал. Тем не менее для ряда лекарственных препаратов — это единственно надежный способ стерилизации в современных условиях.
Использование консервантов. Добавление консервантов условно можно отнести к методам химической стерилизации. Введение консервантов в растворы проводится в тех случаях, когда нельзя гарантировать сохранение стерильности. При этом возможно снижение температуры стерилизации или сокращение времени ее проведения.
Механизмы воздействия консервантов на микроорганизмы очень различны и определяются их химическим строением. Как к основному результату при этом следует отнести нарушение жизненных функций клетки, в частности инактивацию белковой части клеточных ферментов. В зависимости от степени инактивации наступает либо гибель клетки: либо замедление ее жизненных функций.
Физические методы стерилизации
Тепловая (термическая) стерилизация. В настоящее время монопольное положение среди возможных методов стерилизации в фармацевтическом производстве занимает тепловая стерилизация.
В зависимости от температурного режима тепловая стерилизация подразделяется на стерилизацию:
— паром под давлением (автоклавирование);
— текучим паром;
— тиндализацию;
— воздушную.
Стерилизация паром под давлением. Автоклавирование — стерилизация растворов, устойчивых к нагреванию, паром под давлением 1,1 атм при температуре 119—121 °С. Вданных условиях погибают не только вегетативные, но и споровые микроорганизмы зз счет коагуляции белка клетки.
Этот традиционный способ стерилизации сегодня предпочтителен по трем причинам. Во-первых, он дает возможность стерилизации препаратов в конечной герметичной упаковке, что исключает опасность вторичной контаминации. Во-вторых, благодаря длительной практике использования он обеспечен достаточно надежной аппаратурой. И в-третьих, на сегодняшний день он наиболее экономичен.
При применении данного метода происходит комбинированное воздействие на микроорганизмы высокой температуры и влажности, при этом погибают самые стойкие споры. Коагуляция белковых веществ в этих условиях начинается при температуре 56 °С.
Стерилизацию паром под давлением проводят в стерилизаторах различной конструкции цилиндрической или квадратной формы. Стерилизаторы квадратной формы типа АП-7 (рис. 19.25), АП-18 имеют двери с двух сторон: через одну происходит загрузка нестерильной продукции; через другую — выгрузка простерилизованной. Корпус автоклава нагревается глухим паром, чтобы не было его конденсации в рабочей камере. Затем в камеру для вытеснения воздуха подается острый пар. Отсчет времени стерилизации начинается с момента достижения заданного давления по манометру. Стерилизаторы оснащены, автоматической контрольной аппаратурой, с помощью которой на контрольной ленте записывается давление и время стерилизации. Условия стерилизации продукции указаны в промышленных регламентах или другой нормативно-технической документации.
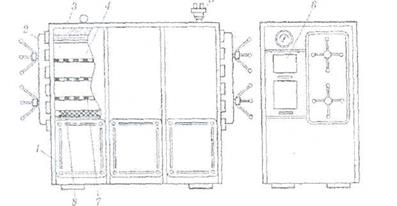
Рис. 21. Устройство парового стерилизатора АП-7:
1 ■— корпус; 2 — крышка; 3 -— теплоизоляция; 4 — стерилизационная камера;
5 — клапан предохранительный; 6 — пульт управления; 7 —- полка;
8 —• подача острого пара
Стерилизацию растительных масел и жиров в заводских условиях осуществляют паром под давлением в герметически закрытых сосудах при температуре 119——121 °С и давлении 1.0— 1,1 атм в течение 2 ч.
Авто клавир о в анию также подвергаются установки для стерилизующего фильтрования, фильтрующие перегородки и другой вспомогательный материал, используемый в технологическом процессе производства инъекционных лекарственных форм.
Среди недостатков метода можно выделить невозможность стерилизации растворов, содержащих термолабильные вещества, опасность работы с паром под давлением, отсыревание многих материалов во время стерилизации и др.
Стерилизация текучим паром. Растворы веществ термически малоустойчивые иногда стерилизуют при 100 °С текучим паром (без примеси воздуха и избыточного давления). Насыщенный пар убивает только вегетативные формы микроорганизмов и при наличии в объекте споровых форм метод неэффективен.
Тиндализация (дробная стерилизация). Для термолабильных веществ, а также для растворов в шприц-ампулах стерилизацию иногда проводят методом тиндализации. Суть метода заключается в трехкратном нагревании растворов до 40—-60 °С с перерывами в сутки.в течение которых объекты термостатируют при температуре 37±1 °С для прорастания споровых форм в вегетативные.
Стерилизация сухим жаром (воздушная стерилизация)- Стерилизация сухим жаром, проводимая в аэростерилах или других аппаратах этого типа, также высокоэффективна. Погибают все формы микроорганизмов за счет пирогенетического разложения белковых веществ. Однако высокая температура нагрева (160— 200 °С), длительное время воздействия (1—2 ч) и сухой горячий воздух оказывают повреждающее действие на стерилизуемые объекты и, следовательно, ограничивают возможности данного Способа.
Инъекционные растворы не подвергают стерилизации сухим жаром, так как из-за низкой теплопроводности воздух не обеспечивает быстрый нагрев растворов до температуры стерилизации, а длительный прогрев — приводит к разложению большинство лекарственных веществ.
Сухим жаром стерилизуют некоторые термостойкие порошки, масла, стеклянную тару (ампулы, флаконы и необходимую посуду), вспомогательные материалы.
Лучшими считают стерилизаторы с ламинарным потоком стерильного воздуха, нагретого до требуемой температуры, что улучшает создание равномерного температурного поля и устраняет загрязнения от обогреваемых стенок камеры и из воздуха, попадаемого в момент выгрузки объекта.
Радиационная стерилизация. Лучистая энергия губительно действует на клетки живого организма, в т. ч, и на различные микроорганизмы. Принцип стерилизующего эффекта этих излучений основан на способности вызывать в живых клетках при определенных дозах поглощенной энергии такие изменения, которые неизбежно приводят их к гибели за счет нарушения метаболических процессов и коагуляции белка.
Источником ионизирующих у-излучений служат долгоживущие изотопы С027, CS66 , ускорители электронов прямого действия и линейные ускорители электронов. Для бактерицидного эффекта достаточно от 15 до 25 кГр, причем верхний предел необходим для инактивации споровых форм.
В настоящее время накоплен большой опыт применения этого метода, точно установлены типичные дозы излучения, необходимые для надежной стерилизации, разработано радиационное оборудование для высокопроизводительного процесса стерилизации, решены вопросы безопасности работы установок для обслуживающего персонала.
Этот метод по экономическим показателям превосходит асептическое изготовление растворов со стерильной фильтрацией, но несколько уступает тепловой стерилизации. Однако в будущем может приблизиться к ней из-за неизбежного снижения относительной стоимости изотопов — побочных продуктов атомной энергетики.
Ультразвуковая стерилизация. Прохождение ультразвука (УЗ) в жидкой среде сопровождается чередующимися сжатиями, разрежениями и большими переменными ускорениями. В жидкости образуются разрывы, называемые кавитационными полостями. В момент сжатия эти полости захлопываются. Избыточное давление, создаваемое УЗ-волной, накладывается на постоянное гидростатическое и суммарно может составлять в пузырьках несколько атмосфер. В качестве «зародышей» кавитационных полостей могут быть пузырьки газа, пара в жидкости, твердые частицы и места неровностей твердой поверхности. Большие импульсные давления кавитаций приводят к разрушению целостности клеточной мембраны микроорганизмов, споровых образований и других частиц. Важно установить оптимальные параметры процесса стерилизации, так как высокие импульсные давления могут приводить к механическому разрушению ампул. Стерилизующая частота звука должна быть в пределах 3 8—22 кГц.
И хотя метод очень эффективен, он не нашел широкого применения из-за сложности аппаратурного оснащения и возможных сложных химических превращений компонентов растворов. Вопросы стабильности компонентов при УЗ-стерилизации имеют много общего с аналогичными проблемами радиационной стерилизации. Для повышения устойчивости лекарств при ультразвуковом воздействии необходимо подобрать такие условиястерилизующей обработки, которые обеспечивают снижение вводимой в систему энергии на тех частотах ультразвука, которые одновременно со стерилизацией не приводят кразложению компонентов лекарственных препаратов.
Чаще метод применим при производстве эмульсий и суспензий с целью лучшего диспергирования веществ в них и одновременно получения стерильных гетерогенных систем для парентерального применения.
Стерилизация токами высокой и сверхвысокой частоты. К настоящему времени нет единой точки зрения на механизм инактивации микроорганизмов при ВЧ- и СВЧ-облучении. Существует мнение об исключительно тепловом механизме действия токов высокой частоты на биологические объекты. Принцип действия высокочастотного поля заключается в его активномвоздействии на ориентацию молекул вещества. Изменение направленности поля вызывает изменение ориентации молекул и поглощение части энергии поля веществом. В результате происходит быстрый нагрев вещества во всех точках его массы. Менее широко распространены представления о том, что, помимо тепловых процессов, на гибель микроорганизмов оказывает влияние специфическое действие ВЧ- и СВЧ-излучения.
С помощью СВЧ-энергии возможно стерилизовать в расфасованном виде готовую продукцию: глазные мази, пасты в тубах, лекарственные средства в конвалютах, порошки, таблетки, пористые лиофилизированные массы, не содержащие гидрофильные жидкости. Стерилизация ампулированныхрастворов и жидких лекарственных форм, укупоренных герметически — нежелательна, так как в замкнутой емкости возникает избыток давления паров испарившейся жидкости, взрывающий ее. В результате наступает разгерметизация в виде растрескивания стенок ампул или срыва укупорочного материала.
Метод также не нашел широкого применения из-за сложности аппаратурного оснащения и возможности неблагоприятного воздействия быстрого кратковременного нагрева инъекционного раствора.
Стерилизация ультрафиолетовым излучением. Из-за возможности образования ядовитых продуктов и возможности разложения биологически активных компонентов инъекционных растворов под действием УФ-излучения, метод не нашел применения для стерилизации препаратов для инъекций. Однако он широко используется для стерилизации порошков, воды для инъекций, вспомогательных материалов, воздушной среды производственных помещений, технологического оборудования и других объектов.
При стерилизации воздушной среды производственных помещений в качестве источников УФ-радиации используют специальные лампы БУВ (бактерицидная увиолевая). которые изготавливают в виде трубки из специального увиолевого стекла, способного пропускать УФ-лучи, с электродами из длинной вольфрамовой спирали, покрытой бария и стронция гидрокарбонатами. В трубке находится ртуть и аргон при давлении в несколько мм рт. ст. Источник УФ-лучей — разряд ртути, происходящий между электродами при подаче на них напряжения. Излучение лампы БУВ обладает большим бактерицидным действием, так как максимум излучения лампы близок к максимуму бактерицидного действия (254 нм).
Количество и мощность бактерицидных ламп подбирается так, чтобы при прямом облучении на 1 м объема помещения приходилось не менее 2—2,5 Вт мощности излучателя. Промышленностью выпускаются лампы БУВ-15, БУВ-30, БУВ-60 и др. (цифра обозначает мощность в ваттах), а также бактерицидные облучатели: настенный ОБН, состоящий из двух ламп БУВ-30; потолочный ОБП — из 4 ламп БУВ-30; передвижной маячного типа ОБПЕ -из 6 ламп БУВ-30. Облучатели используют только при отсутствии в помещении людей.
Для стерилизации воды применяют аппараты с погруженными и непогруженными источниками УФ-радиации. В аппаратах первого типа источник УФ-излучения (бактерицидная увиолевая лампа, покрытая кожухом из кварцевого стекла) помещается внутри водопровода и обтекается водой. Данный способ стерилизации больших объемов воды для инъекций считается наиболее экономичным.
В аппаратах с непогруженными лампами они помещаются над поверхностью облучаемой воды. В связи с тем что обычное стекло практически непроницаемо для ультрафиолетовыхлу^чей, водопровод в местах облучения изготавливают из кварцевого стекла, а это значительно повышает стоимость аппарата. В настоящее время разработан способ, при применении которого имеется возможность замены кварцевого стекла полиэтиленовым, свободно пропускающим УФ-радиацию.
Как положительный фактор 'следует отметить, что при стерилизации воды не происходит накопления пероксидных соединений и под действием УФ-излучения инактивируются некоторые пирогенные вещества, попавшие в воду.
Стерилизация ИК- и лазерным излучением. Электронная стерилизация.
Эти перспективные виды стерилизации практически не находят сегодня применения, хотя возможности для этого имеются.
Облучение инъекционных водных систем инфракрасным (ИК) излучением в областях поглощения воды (К—2,1 мкм) может быть эффективным средством ее нагрева и тем самым является, по сути, еще одним вариантом тепловой стерилизации. Наличие достаточно мощных источников ИК-излучения позволяет надеяться на возможность создания оборудования для высокопроизводительной технологии. Преимуществом этого метода перед традиционным автоклавированием может считаться возможность отказа от небезопасного в обслуживании и нетехнологичного перегретого пара.
Принципиально возможны способы стерилизации с применением лазерного и электронного излучения, при этом можно достигнуть высокой эффективности стерилизации как путем интенсивного нагрева вследствие поглощения мощного излучения в воде, так и за счет селективного поглощения излучения макромолекулами микроорганизмов в многоквантовых процессах. Однако исчерпывающих исследований применительно к какой-либо конкретной системе, совокупность которых дала бы основание о создании хотя бы основ таких методов стерилизации, пока не проведено.
Вопрос 3. пустырник сердечный (п. обыкновенного) — Leonurus cardiaca L и п. пятилопастного (п. мохнатого) — L quinquelobatus Gilib.(L. villosus Desf. ex Spreng.) из сем. губоцветных — Lamiaceae (Labiatae); используют в качестве лекарственного средства и лекарственного сырья.
Химический состав.В траве пустырника содержатся флавоноидные гликозиды — рутин, квинквелозид, космосиин, кверцитрин, гиперозид, кверцимеритрин; дубильные вещества (до 2.5 %); иридоиды (аюгол, аюгозид и галиридозид); горькие гликозиды со стероидным скелетом иазотистые основания (холин, стахидрин).
Внешние признаки.Трава ручной уборки состоит из цветущих верхушек со стеблем длиной до 40 см, толщиной до 0,5 см.
Трава механизированной уборки представляет собой куски стеблей, листьев и соцветий. Стебель часто продольно расщепленный, длиной до 20 см, толщиной до 0,5 см.
Измельченное сырье. Кусочки стеблей, листьев и соцветий, проходящие сквозь сито с отверстиями диаметром 7 мм. Цвет серовато-зеленый. Запах слабый. Вкус горьковатый.
Порошок. Кусочки стеблей, цветоносов и цветков, проходящие сквозь сито с отверстиями диаметром 2 мм. Цвет от серовато-зеленого до коричневато-зеленого с многочисленными беловатыми, желтовато-белым и, серовато-белыми, розово-фиолетовыми вкраплениями.
Микроскопия.При рассматривании листа с поверхности характерным является наличие эфирномасличных железок с короткой ножкой и 4-6 (реже 8) выделительными клетками. Встречается два типа волосков: многоклеточные грубобородавчатые. расширенные в местах сочленения клеток; мелкие головчатые волоски на одно- или двуклеточной ножке с округлой головкой (из 1-2 клеток). Устьица окружены 4-5 околоустьичными клетками (аномоцитный тип) в отличие от обычного диацитного типа у большинства представителей губоцветных.
В порошке видны фрагменты листьев, стеблей и цветков. Эпидермис стебля образован сильно вытянутыми клетками с прямыми стенками, а клетки эпидермиса чашечки и венчика очень мелкие. Все частицы порошка (листьев, стеблей и цветков) опушены многочисленными простыми бородавчатыми волосками, более редко встречаютсяголовчатые волоски и округлые эфирномасличные железки; встречаются также шаровидны пыльцевые зерна.
Качественные реакции. 1. Метод флуориметрии. При смачивании порошка травы 1 % спиртовым раствором алюминия хлорида и просвечивании его в УФ-свете все ткани флуоресцируют ярко-золотисто-желтым цветом (флавоноиды).
2. Метод ТСХ. Проводят экстракцию и очистку суммы флавоноидов на колонке с полиамидным сорбентом. На стартовую линию хроматографической пластинки «Силуфол» (15X15 см) наносят макропипеткой 0,05 мл раствора А в виде полосы длиной 2 см и шириной 0,5—0.6 см. Рядом, на расстоянии 1,5 см от края полосы, на стартовую линию наносят в виде точки 0.005 мл 1 % раствора Государственного стандартного образца (ГСО) гиперозида.* Пластинку с нанесенными пробами высушивают на воздухе в течение 20 мин, затем помещают в камеру со смесью растворителей хлороформ — метиловый спирт (8:2) и хроматографируют восходящим способом (камеру предварительно насыщают не менее 40 мин). Когда фронт растворителей пройдет до конца пластинки, ее вынимают из камеры, высушивают вытяжном шкафу в течение 2 мин и просматривают в УФ-свете при длине волны 360 нм.
На уровне пятна ГСО гиперозида должна появиться полоса темно-коричневого цвета. Затем пластинку обрабатывают 5 % спиртовым раствором алюминия хлорида и нагревают ее в течение 2-3 мин в сушильном шкафу при температуре 100—105° С. При этом пятно приобретает ярко-желтую окраску в видимом и яркую желто-зеленую флюоресценцию в УФ-свете (гиперозид).
Хранение. На аптечных складах хранят на стеллажах, в сухом, прохладном, затемненном, проветриваимом помещении. Срок годности 3 года.
Использование. Для получения настоя и настойки, которые применются как седативное средство, взамен препаратов валерианы и совместно с ними, при повышенной нервной возбудимости, сердечно-сосудистых неврозах и начальных стадиях гипертонической болезни. Выпускает брикетах, в резано-прессован виде и фильтр-пакетах.
Используется в гомеопатии.
Вопрос 4. Требование выписано не верно. Не указано назначение лек. форы (для инфузий). На требовании нет круглой печати ЛПУ. Требование выписывается в 3 экз.
Оплата производится безналичным путем.
Для обеспечения лечебно-диагностического процесса ЛПУ получают ЛС из аптеки согласно требованиям. Требование должно иметь штамп, круглую печать ЛПУ. подпись его руководителя или его заместителя по лечебной части. В требовании указываются наименование ЛС, дозировка и форма изготовления (таблетки, ампулы, мази, суппозитории и т.д.), общее количество и вид упаковки (коробки, флаконы, тубы и пр.).
Наименования ЛС пишутся на латинском языке. В требовании указывается способ применения ЛС: для инъекций, для наружного применения, для приема внутрь, глазные капли и т.д.
Требования в межбольничные аптеки выписываются в трех экземплярах, а на ЛС. подлежащие предметно-количественному учету (ПКУ), — в четырех экземплярах, из которых два остаются в аптеке, а два возвращаются вместе с товаром в ЛПУ.
Лекарственные препараты отпускаются в отделения ЛПУ в размере текущей потребности:
наркотические Л С на 3 дня (в приемном отделении на 5 дней);
ядовитые ЛС на 5 дней;
все остальные ЛС на 10 дней (р-р Рингера-Локка).
Отпуск ЛС производится из аптек материально ответственным лицам отделений ЛПУ (старшим медицинским сестрам). Лекарственные препараты из больничной аптеки отпускаются медицинским сестрам без оформления доверенности, а из МБА по
доверенности.На получение ядовитых ЛС, а также этилового спирта выписываются отдельные доверенности, действительные в течение 1 мес. На получение наркотических и психотропных средств доверенность действительна в течение 15 дней.
На всех этикетках для оформления ЛП, приготовляемых для ЛПУ; должны быть следующие обозначения:
местонахождение аптечной организации;
наименование аптечной организации;
больница №;
отделение;
дата изготовления:
срок годности, ... дней;
приготовил ..., проверил .... отпустил ...;
анализ № ...;
способ применения (внутреннее, наружное, для инъекций) или вид ЛФ (глазные капли, мазь и т.д.);
состав ЛП (предусматривается место для указания состава). На этикетках для инъекций должен быть указан подробный способ применения лекарства: «Внутривенно», «Внутривенно (капельно)», «Внутримышечно». Состав ЛП указывается на латинском языке, пишется от руки или наносится штампом. Наименования ЛП. часто встречающихся в рецептуре аптек, могут быть напечатаны типографским способом. Все обозначения в тексте этикеток, способ применения и предупредительные надписи должны быть напечатаны типографским способом на русском или национальном языке.
Получение и отпуск из аптеки ценностей оформляется соответствующими подписями во всех экземплярах накладных-требований. При этом старшие сестры получают один экземпляр, протаксированный по каждой лекарственной форме. Работник аптеки расписывается в выдаче лекарственных средств и правильности таксировки на всех экземплярах накладных-требований. Накладные-требования, по которым отпущены лекарственные средства, содержащие ядовитые вещества, хранятся в аптеке в течение 2 лет, наркотические — 5 лет, а все остальные — 1 год.
Раствор Рингера-локка хранится 30 сут при Т не выше 25 С.
/V Билет 1 hj^onpoc 1. Herba Adonidis vemalis — трава горицвета весеннего (Adonidis vernalis ЬегБа - адониса весеннего трава)
Горицвет весенний (адониса весеннего) — Adonis vernalis L. из сем. лютиковых (Ranunculaceae); используют в качестве лекарственного средства и лекарственного сырья.
Химический состав. Трава содержит свыше 20 кардиотонических гликозидов (типа карденолидов), производных строфантидина и адонитоксигенина. Основные карденолиды — адонитоксин, цимарин, К-строфантин-в.
Числовые показатели. Биологическая активность 1 г травы должна быть 50-60 ЛЕД или 6,3-8 КЕД; влажность не более 13 %; золы обшей не более 12 %; побуревших частей растения не более 3 %; растений со стеблями, имеющими бурые чешуйчатые листья, не более 2 %; содержание органической примеси не более 2 %, минеральной — не более 0,5 %.Для измельченного сырья: частиц, не проходящих сквозь сито с диаметром отверстий 7 мм, не более 10 %, частиц, проходящих сквозь сито с отверстиями размером 0,25 мм, не более 10%. Активность травы горицвета определяют биологическим методом на лягушках или кошках по сравнению с Государственным стандартным образцом (ГСО) цимарина.
Испытание на лягушках. Испытание проводят на травяных лягушках, вводя растворы в лимфатические бедренные мешки (под кожу) или в сердце (в полость желудочка), либо на водяных, вводя растворы в сердце (в полость желудочка) или в вену.
Аналитическую пробу сырья измельчают до размера частиц, проходящих сквозь сито с отверстиями диаметром 7 мм, и сушат в сушильном шкафу в течение 2 ч при температуре 40—60 °С.
Извлечение из травы горицвета готовят в зависимости от способа введения.
Для подкожного введения 5 г измельченного и высушенного сырья экстрагируют 100 мл 95% спирта в аппарате Сокслета в течение 6—8 ч.
Извлечение собирают в цилиндр вместимостью 100 мл и доводят объем 95% спиртом до метки (3:20).
Для внутри сердечно го и внутривенного введения 5 г измельченного и высушенного сырья помещают в колбу с притертой пробкой вместимостью 500 мл, прибавляют 110 мл 75% спирта (по объему) и оставляют на сутки. Затем к колбе присоединяют обратный холодильник, помещают колбу на кипящую водяную баню и экстрагируют в течение 1 ч. Извлечение охлаждают, фильтруют в цилиндр вместимостью 100 мл через четырехсложный фильтр из марли и доводят объем 75 % спиртом до метки (1 :20). Извлечение пригодно в течение 2 сут со дня приготовления.
Стандартный и испытуемый образцы готовят в день опыта.
К 2 мл раствора ГСО цимарина 1 : 3333 прибавляют 6 мл воды (1 :4).
20 мл спиртового извлечения (1 :20) травы горицвета выпаривают на кипящей водяной бане до 2 мл и доводят объем водой до 20 мл. Образующуюся при этом муть или осадок не отфильтровывают, а прибавляют 1—2 капли 5% раствора натрия гидрокарбоната. Полученное таким путем спиртоводное извлечение (1 : 20) испытывают на лягушках.
Определив наименьшие дозы стандартного и испытуемого образцов, вызывающие систолическую остановку сердца у большинства лягушек (в миллилитрах на массу травяной лягушки или в миллилитрах на 1 г массы водяной лягушки), вычисляют содержание ЛЕД в 1 г травы горицвета.
Испытание на кошках. Из измельченной и высушенной травы горицвета готовят настой в соотношении 1,5: 200. Для этого 1,5 г травы горицвета помещают в инфундирный аппарат, обливают 200 мл кипящей воды и настаивают в течение 25 мин на водяной бане при 90 °С и частом взбалтывании. Затем настой охлаждают, фильтруют, к фильтрату прибавляют 1,8 г натрия хлорида и доводят объем настоя водой до 200 мл.
ГСО цимарина разводят в день опыта 0,9 % раствором натрия хлорида в соотношении 1 : 100 000.
Устанавливают смертельную дозу настоя в миллилитрах на 1 кг массы кошки (для каждого животного в отдельности) и рассчитывают активность травы горицвета в сравнении с ГСО цимарина или вычисляют содержание КЕД в 1 г травы.
Хранение. Сырье хранят с предосторожностью по списку Б, на подтоварниках в сухом, хорошо проветриваемом помещении под замком при температуре не выше 15 °С и относительной влажности воздуха 30-50 %. Биологическая активность сырья контролируется ежегодно (!).
Использование. В настоящее время трава используется для получения настоя, сухого экстракта, который входит в состав препаратов «Адонис-бром» и «Адонизид». Препараты обладают кардиотоническим и седативным действием и применяются при сердечной недостаточности.Упаковка. Цельное сырье упаковывают в тюки из ткани не более 50 кг нетто или в мешки тканевые или льноджутокенафные не более 15 кг нетто: измельченное —■ в мешки тканевые или льноджутокенафные не более 25 кг нетто.
Хранение. Список Б.
Активность травы горицвета контролируют ежегодно. Вопрос 2. /
По химической структуре сердечные гликозиды представляют собой эфиры. в моле: которых гликозидной связью связаны между собой агликон и остатки моно-,ди-, три тетрасахарида. Сахара, входящие в состав сердечных гликозидов, за исключением глюк рамнозы, специфичны для данной группы веществ и представляют собой 6-дезоксиге] или их 3-О-метиловые эфиры. Из сердечных гликозидов выделено более 50 углев Важнейшими моносахаридами, входящими в состав сердечных гликозидов. являются:
СН2ОН

Агликоны (генины) сердечных гликозидов имеют стероидную структуру, т. е. являются троизводными циклопентанпергидрофенантрена. Они представляют собой ненасыщенные стероидные лактоны. По химическому строению агликоны можно разделить на две группы, сличающиеся структурой присоединенного в положении ] 7 лактонного цикла, который )бычно занимает в-конфигурацию. Пятичленный лактонный цикл входит в структуру 1ГЛИКОНОВ карденолидов, а шестичленный — буфадиенолидов
Карденолиды содержатся в различных видах наперстянки, строфанта, ландыша, келтушника, олеандра, горицвета весеннего и др. Буфадиенолиды входят в состав шрозника. морского лука, а также найдены у животных (жабы).
Большинство сердечных гликозидов по химическому строению представляют собой :арденолиды. Их агликоны имеют общую Аопмулу
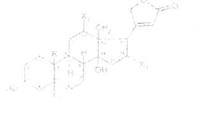
и отличаются друг от друга радикалами :R, X^X^ Х3
Молекула сердечного гликозида включает один, два или три остатка указанных выше Сахаров, соединенных в положении 3 с агликоном а- или в-гликозидной связью.
Объективную оценку подлинности сложных по химической структуре индивидуальных сердечных гликозидов позволяет сделать ИК-спектр, снятый после прессования в таблетках с бромидом калия в области 4000-400 см-1.
Для установления подлинности сердечных гликозидов могут быть использованы обшие химические реакции. Первая группа цветных реакций позволяет обнаружить наличие стероидного цикла в молекуле, например реакция Либермана — Бурхардта. Она основана на способности стероидов к дегидратации под действием уксусного ангидрида и концентрированной ' серной кислоты. В результате реакции слой уксусного ангидрида окрашивается в зеленый цвет.
Стероидный цикл в карденолидах обнаруживают флуориметрическим методом, используя в качестве реактива смесь фосфорной и серной кислот с хлоридом железа (III), раствор перхлората железа в серной кислоте и др. Реакции приемлемы тогда, когда анализируемый гликозид в результате дегидрирования образует окрашенные моно- или диангидридопроизводные. К реакцию с концентрированной серной кислотой (зеленое окрашивание).
Вторая группа цветных реакций основана на обнаружении пятичленного лактонного цикла с двойной связью в а.в-положении в молекуле карденолидов. К их числу относится реакция Легаля, суть которой заключается в образовании окрашенного в красный цвет продукта при взаимодействии сердечного гликозида с раствором нитропруссида натрия в шелочной среде. Пятичленный лактонный цикл можно также обнаружить по образованию окрашенных в оранжево-красный цвет продуктов взаимодействия сердечных гликозидов со щелочным раствором пикриновой кислоты (реакция Балье):
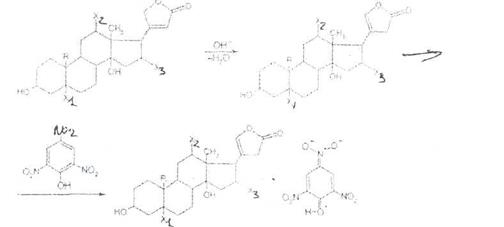
Третья группа реакций основана на обнаружении сахарного компонента в сердечных гликозидах. Для этой цели могут быть использованы свойственные сахарам реакции, основанные на их восстановительных свойствах (реакция с реактивом Фелинга, реакция «серебряного зеркала» и др.).
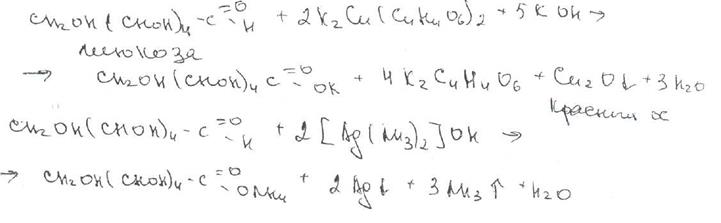
Но наиболее широко применяют специфичную на 2-дезоксисахара (содержащиеся в молекулах большинства сердечных гликозидов) реакцию Келлера — Кипиаки. Из различных способов ФС рекомендует методику, заключающуюся в предварительном растворении 1-2 мг гликозида в ледяной уксусной кислоте, содержащей 0,05%-ного хлорида железа (III). Раствор осторожно вливают в пробирку с концентрированной серной кислотой и наблюдают окраску верхнего слоя, подтверждающую наличие в молекуле сахара — дигитоксозы (сине-зеленый цвет) и наличие агликона— дигитоксигенина по окраске на границе двух слоев (лилово-красной или бурой). Этим способом устанавливают подлинность дигитокеина.
Дезоксисахара можно обнаружить с помощью ксантгидрола (реакция Пезеца). При нагревании ксантгидрола (дибензо-у-пиранола) с испытуемым гликозидом в присутствии ледяной уксусной кислоты и последующем прибавлении нескольких капель серной или фосфорной кислоты появляется красное окрашивание. Аналогичную цветную реакцию дает антрон. Методика основана на образовании фурфурола или его производных из сахарных компонентов под действием концентрированной серной кислоты. Фурфурол с антроном затем дает продукт конденсации, окрашенный в зеленый или сине-зеленый цвет:
Подлинность сердечных гликозидов можно подтвердить по удельному вращению.
При испытании на чистоту лекарственных препаратов сердечных гликозидов определяют потерю в массе при высушивании, сульфатную золу и тяжёлые металлы, прозрачность и цветность растворов, но особое внимание следует обращать на натичие примеси посторонних гликозидов.
Применение спектрофотометрии для идентификации и количественного определения сердечных гликозидов оказалось возможным благодаря избирательному поглощению в УФ-области спектра (215-220 нм), обусловленному наличием в агликонах а, в-ненасыщенного лактонного цикла. Например, количественно определить дигитоксин можно при длине волны 215 и 219 нм.
Кроме того, сердечные гликозиды определяют в щелочной среде, фотометрируя окрашенные продукты их взаимодействия с нитропроизводными ароматического ряда. Значения молярных показателей поглощения образующихся окрашенных комплексов (чувствительность реакций) находятся в зависимости от химической структуры нитропроизводных: с 2,4-динитродифенилсульфоном 24600-24800, с пикриновой кислотой 14000-18800, с 3,5-динитробензойной кислотой 6000-9700. Наиболее широко применяют в качестве реактива пикриновую кислоту или пикрат натрия {реакция Балье) для определения дигитокеина, дигоксина, строфантина Г и др. Параллельно в тех же условиях получают и измеряют оптическую плотность пикрата стандартного образца. По нему рассчитывают содержание дигитокеина (95-105%). Содержание суммы сердечных гликозидов вычисляют по калибровочному графику.
Качественную и количественную оценку сердечных гликозидов выполняют также с помощью метода ВЭЖХ, отличающегося высокой чувствительностью и позволяющего определить не только основные, но и сопутствующие гликозиды. Этот метод дает результаты, сопоставимые с биологическим контролем. ФС на дигоксин рекомендует метод ВЭЖХ для установления подлинности по идентичности времени удерживания основного пика на хроматограммах растворов испытуемого и стандартного образцов.
Биологическим методом активность устанавливают сравнением с препаратами-стандартами и выражают в ЛЕД (лягушачьих), КЕД (кошачьих) или ГЕД (голубиных) . единицах действия. При биологическом методе контроля устанавливают наименьшие дозы стандартного и испытуемого лекарственного препарата, которые вызывают систолическуюостановку сердца подопытных животных. Затем рассчитывают содержание единиц действия (ЕД) в 1,0 г исследуемого препарата, в одной таблетке или в 1 мл раствора (ГФ XL вып. 2, с. 163). Недостаток биологического контроля — трудоемкость, длительность и малая точность. Нередко его сочетают с применением физико-химических методов.
Ряд сердечных гликозидов и их лекарственных форм могут быть определены полярографическим методом. Достоинство этого метода заключается в том, что определение выполняется за счет восстановления двойной связи, сопряженной с карбонильной группой лактонного цикла. Эта система, как известно, является одним из факторов, обусловливающим биологическую активность сердечных гликозидов. Еще более широкие возможности достигаются при применении полярографии в сочетании с предварительным хроматографическим разделением.
Хранение и применение
Лекарственные препараты сердечных гликозидов хранят по списку А, в хорошо укупоренной таре, предохраняющей от действия света и влаги Большое влияние на стабильность гликозидов, особенно в растительном сырье, оказывают ферменты. Поэтому при его хранении и получении лекарственных веществ ферменты необходимо инактивировать. Это достигается путём высушивания сырья при 40-60 °С или обработки его парами этанола, эфира, хлороформа. После этого стабильность гликозидов значительно повышается.
Сердечные гликозиды, как правило, являются нейтральными соединениями. Они чувствительны к воздействию как кислот, так и щелочей. Под влиянием кислот, даже таких слабых, как уксусная, происходит отщепление легко гидролизуемых 2-дезоксисахаров, являющихся составными компонентами сердечных гликозидов. В щелочной среде происходит необратимая изомеризация карденолидов или расщепление лактонного цикла с образованием фармакологически неактивных соединений. Под влиянием щелочи в лактонном цикле может происходить перемещение двойной связи из а-в положения в в-у положение. Процесс гидролиза гликозидов сопровождается последовательным отщеплением моносахаридов, входящих в состав сахарного компонента. Установить стабильность сердечных гликозидов можно по отсутствию восстановительной способности, т.к. у них замещён полуацетальный гидроксил.
Сердечные гликозиды применяют в качестве кардиотонических средств при острой и хронической недостаточности кровообращения или сердечно-сосудистой недостаточности. Отличаются они по силе, продолжительности, скорости проявления действия, влиянию на центральную нервную систему.
Наиболее эффективны эти лекарственные препараты при внутривенном введении. Для этого их предварительно растворяют в 20-40%-ном растворе глюкозы или в изотоническом растворе до 0,025%-ной концентрации. Высшие разовые дозы индивидуальных сердечных глнкозидов составляют 0,5 мг, суточные — 1,0 мг. Передозировка вызывает резкое нарушение сердечной деятельности. Это обусловило необходимость их включения в список А. Следует учитывать способность сердечных гликозидов постепенно накапливаться в организме (степень кумуляции).
Вопрос 3. Адонизид относится к группе новогаленовых препаратов. Новогаленовые (максимально очищенные экстракционные) препараты — это фитопрепараты, содержащие в своем составе действующие вещества исходного лекарственного сырья, в их нативном (природном) состоянии, максимально освобожденные от балластных веществ. Глубокая очистка повышает их стабильность, устраняет побочное действие ряда балластных веществ (смолы, танниды и др.), позволяет использовать для инъекционного применения. Кроме того, в отличии от галеновых, которые в ряде случаев стандартизуют по сухом;' остатку, новогаленовые препараты выпускают стандартизованными биологическими или химическими методами по действующим веществам.Технология новогаленовых препаратов характеризуется резко выраженным индивидуальным подходом, обусловленным характером исходного лекарственного растительного сырья, свойствами действующих и сопутствующих веществ и типом получаемого препарата. '/Технологический процесс складывается из следующих стадий: экстракция лекарственного растительного сырья, очистка экстракта, стандартизация, получение лекарственных форм.
V Большое внимание уделяют выбору экстрагента и метода экстракции. Экстрагент подбирают с учетом избирательности (селективности), т. е. стремятся к тому, чтобы он максимально извлекал комплекс действующих веществ и как можно меньше сопутствующих. При этом он должен не только хорошо растворять действующие вещества, но и легко десорбировать их с растительного материала. Последним обстоятельством объясняется использование смеси растворителей. При получении новогаленовых препаратов наряду с широко употребляемыми экстрагентами (этанол, вода) используют водные растворы кислот, солей, смеси этанола с хлороформом и др.
\/При выборе метода экстракции стремятся с наименьшей затратой времени и экстрагента получить концентрированное, т. е. обогащенное действующими веществами, извлечение. Йболее широко при получении новогаленовых препаратов используют противоточную экстракцию, иногда мацерацию с циркуляцией экстрагента или с механическим перемешиванием (при работающей мешалке); при применении легко летучих экстрагентов — циркуляционную экстракцию.
Ряд новогаленовых препаратов (адонизид, лантозид, дигален-нео, коргликон, эрготал) являются официальными и включены в ГФ XI. Наряду с ними промышленность выпускает новогаленовые препараты, которые нормируются ВФС. Следует отметить, что самую большую группу составляют препараты, получаемые из лекарственного растительного сырья, содержащего сердечные гликозиды. Это и понятно, так как до настоящего времени растительное сырье является единственным источником получения сердечных гликозидов. Отдельные новогаленовые препараты получают из
лекарственного растительного сырья, содержащего алкалоиды, флавоноиды,
полисахариды и другие действующие вещества.
Адонизид (Adonisidum) получают из травы адониса весеннего (горицвета или черногорки) (Adonis vernalis L.) Технология препарата разработана Ф Д. Зильберг (ВНИХФИ). Измельченную траву горицвета весеннего (активность не менее 50—66 ЛЕД в 1 г) экстрагируют циркуляционным способом в аппарате типа Сокслета. В качестве экстрагента используют смесь, состоящую из 95 частей хлороформа и 5 частей 96 % этанола по объему. Указанный экстрагент получил название универсального, так как относительно хорошо извлекает все сердечные гликозиды. В то же время сопутствующие гидрофильные вещества переходят в эту смесь в незначительных количествах. Экстракцию растительного сырья проводят до полного извлечения гликозидов. В полученном извлечении наряду с гликозидами (адонитоксин, цимарин и др.) содержатся хлорофилл, органические кислоты, смолоподобные вещества и др. Отделение суммы гликозидов от основной массы гидрофобных сопутствующих веществ осуществляют путем смены растворителя. Для этого из полученного извлечения отгоняют экстрагент при температуре не выше 60 °С и разрежении не менее 59994,9 Н/м2. Когда кубовый остаток в испарителе по массе приблизительно будет равен взятому сырью, к нему добавляют равное количество воды и продолжают упаривание до полного удаления хлороформа и этанола При этом в осадок выпадают все нерастворимые в воде вещества (хлорофилл, смолы и др). Водный раствор, содержащий сумму гликозидов, небольшое количество пигментов и других балластных веществ, сливают с осадка и фильтруют на нучт-фильтре через двойной слой фильтровальной бумаги и слой алюминия оксида толщиной 1 —1,5 см Эта операция служит для удаления оставшихся в растворе балластных веществ, причем алюминия оксид практически не адсорбирует сердечные гликозиды и они переходят в фильтрат.В фильтрате определяют биологическую активность. Из 275 кг травы горицвета {50—60 ЛЕД) получают около 100 кг концентрата адонизида (100—200 ЛЕД в 1 мл) После этого к концентрату добавляют этанол, хлорбутанолгидрат и воду в таком количестве, чтобы в 1 мл конечного продукта содержалось 20 % этанола, 0,5 % хлорбутанолгидрата и 23—27 ЛЕД. Предназначен препарат для внутреннего применения и выпускается во флаконах темного стекла по 15 мл. Хранят адонизид в прохладном, защищенном от света месте, список Б. Препарат контролируют ежегодно. Применяют в качестве сердечного (кардиотонического) средства
А д о н и з и д-к онцентрат с активностью 85—100 ЛЕД в 1 мл и содержанием этанола не менее 20 % выпускается в бутылях, как полуфабрикат, который используется для производства препарата «Кардиовален». Список А.
«С ухойадонизид» предложен Н. А Бугрим и Д. Г. Колесниковым (ХНИХФИ). Он получен дополнительной очисткой адонизада-концентрата. Сумму гликозидов экстрагируют из водного раствора хлороформ-этанольной смесью (2:1). Полученное извлечение упаривают, остаток растворяют в 20 % этаноле и раствор пропускают через колонку, заполненную алюминия оксидом сорта «для хроматографии». Колонку промывают 20 % этанолом до отрицаводорода перекиси. Магния перекись применяют при желудочно-кишечных заболеваниях по 0,25- 0.5 г 3-4 раза в день.
Приготовление микстуры.
Жидкие лекарственные формы — свободные дисперсные системы, в которых лекарственные вещества распределены в жидкой дисперсионной среде.
Растворы (solutiones) представляют собой жидкуюлекарственную форму, полученную путем растворения одного или нескольких лекарственных веществ в растворителе и предназначенную для инъекций, внутреннего или наружного применения. Они представляют собой однофазные системы переменного состава, образованные не менее чем двумя независимыми компонентами.
По физико-химическим свойствам растворы занимают промежуточное положение между химическими соединениями и механическими взвесями.
От первых они отличаются переменностью состава, от вторых — однородностью. Растворы — самая крупная группа жидких лекарственных форм, отличающаяся большим разнообразием состава и способов применения. Подавляющее большинство растворов изготавливается в аптеке ex tempore по магистральным прописям. На долю растворов приходится в среднем до 30% обшей рецептуры аптек.
Растворы являются самой значительной группой лекарственных форм. Как лекарственная форма, растворы имеют ряд преимуществ:
1) лекарственные вещества в жидком состоянии по сравнению со многими другими лекарственными формами, особенно твердыми (порошками, таблетками, пилюлями), быстрее всасываются и скорее оказывают терапевтическое действие;
2) применение жидких лекарственных форм не вызывает отражающего действия высоких концентраций и лекарственных веществ, которые образуются при контакте слизистой оболочки с порошками или таблетками (например, калия или аммония бромиды, йодиды и др.), что исключает раздражающее действие на слизистые оболочки;
3) растворы удобны в применении:
4) обладают достаточно простой технологией приготовления. Однако растворы не лишены и некоторых недостатков, которые, впрочем, не влияют на широкое их применение. Эти лекарственные формы не отличаются портативностью, при хранении часто оказываются неустойчивыми.
Кроме того, горький вкус многих лекарств усиливается при их • растворении
Проверка доз:
Адонизид - список Б
ВРД- 40 кап РД-(5*34кап):13=13 кап
Дозы не завышены.
Расчеты:
Р-ра кальция хлорида (1:2) -10*2 = 20 мл
Р-ра натрия бромида (1:5) - 3*5 = 15 мл
Глюкозы 5*100/100-10,4=5,58 г
Адонизида 5 мл
Воды очищенной - 2Q0 - (20+15У=1б5 мл
V= 205ml
Технология. В подставке в 165 мл воды растворяют 5,58 г глюкозы, раствор фильтруют в отпускной флакон оранж. стекла, затем во флакон отмеривают 20 мл р-ра кальция хлорида и 15 мл р-ра натрия бромида. В последнюю очередь добавляют осторожно 5 мл адонизида (спиртосодер. добавл. в последнюю очередь для предупреждения выпадения в осадок водорастворимых в-в). Укупоривают, взбалтывают.
Обязат виды контроля: письмен, органолепт, при отпуске.
Сроки и усл. хр. 10 дней в защищ. от света месте при Т не выше 25С.
ППК
Sol. Calcii chloride (1:2)20 ml
Sol. Natrii bromidi (1:5)15 ml
Дата добавления: 2015-08-04; просмотров: 2030;
