Особенности газовой среды
Газ – это совокупность хаотически движущихся с разными скоростями молекул. В газе образуются молекулы из однотипных атомов (О2, Н2, N2), между молекулами действуют силы Ван-дер-Ваальса. Энергия этих сил меньше, чем энергия теплового движения, и связь между молекулами очень мала. В результате газ способен занимать любой по величине объем и любую форму. Характеристики газовой среды принято рассматривать на базе «идеального газа», имеющего следующие свойства:
1) размеры молекул и атомов много меньше расстояний между ними;
2) взаимодействие между частицами газа осуществляется только при их соударении;
3) все частицы находятся в свободном, хаотическом, тепловом движении.
Состояние газовой среды характеризуется рядом параметров:
1) V – объем, который занимает газ;
2) Т – температура, характеризующая тепловое движение;
3) n – концентрация (число частиц, находящихся в элементарном объеме);
4) р – давление (сила воздействия газа на стенки сосуда, ограничивающего объем).
При хаотическом движении молекул газа их скорости различны как по величине, так и по направлению. В «идеальном газе» распределение молекул по скоростям (энергиям) подчиняется статистике Максвелла-Больцмана. Основные уравнения этой статистики даны в курсе физики. Мы рассмотрим только функцию распределения молекул по скоростям и основные скорости (рис. 2.1).
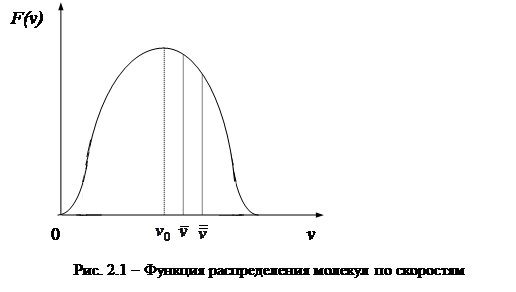 |
Функция распределения молекул по скоростям имеет максимум при скорости 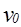 (наиболее вероятная скорость),
(наиболее вероятная скорость), 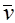 – средняя скорость молекул,
– средняя скорость молекул, 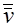 – среднеквадратичная скорость. Эти скорости связаны с температурой газа следующими соотношениями:
– среднеквадратичная скорость. Эти скорости связаны с температурой газа следующими соотношениями:
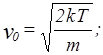
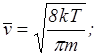
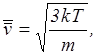
где 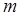 – масса частицы;
– масса частицы;
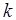 – 1,38×10-23 Дж/град – постоянная Больцмана.
– 1,38×10-23 Дж/град – постоянная Больцмана.
Абсолютные значения 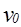 ,
, 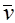 и
и 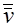 соотносятся как 1:1,1284:1,2247.
соотносятся как 1:1,1284:1,2247.
Если газ заключен в сосуде, то в результате ударов молекул о стенки последние испытывают давление, величина которого 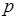 зависит от концентрации молекул
зависит от концентрации молекул 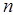 , их массы
, их массы 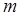 и скорости движения
и скорости движения 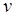 . Согласно кинетической теории газов
. Согласно кинетической теории газов
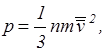 или
или
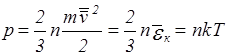 (Па),
(Па),
где 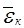 – средняя кинетическая энергия молекул.
– средняя кинетическая энергия молекул.
В СИ единицей измерения давления является паскаль (Па). Подставив в уравнение давления значение постоянной Больцмана и решив его относительно 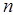 , найдем
, найдем
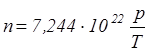 (м–3).
(м–3).
Из уравнения давления получаем еще одно важное соотношение
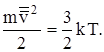
Средняя кинетическая энергия молекул газа прямо пропорциональна его температуре. Следовательно, скорость хаотического движения молекул можно характеризовать температурой газа.
Важной для последующего изложения является формула, выражающая зависимость давления воздуха, окружающего землю, от высоты  :
:
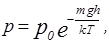

где 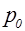 – давление у поверхности Земли;
– давление у поверхности Земли;
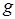 – ускорение силы тяжести.
– ускорение силы тяжести.
Эта формула в физике называется барометрической. Переходя от давления к концентрации молекул, получим
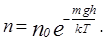
Величина 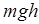 – потенциальная энергия
– потенциальная энергия 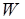 молекул газа на высоте
молекул газа на высоте 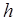 . Поэтому уравнение можно переписать так:
. Поэтому уравнение можно переписать так:
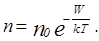
Полученное распределение называют распределением Больцмана. Формулу можно использовать для нахождения концентрации электронов или ионов в электрическом поле.
Дата добавления: 2015-08-01; просмотров: 2145;
