Строение мышц. Химический состав и строение мышц.
Химический состав и строение мышц.
Механизм мышечного сокращения.
Строение мышц
При изучении скелетных мышц с помощью светового микроскопа в них обнаружили поперечную исчерченность; отсюда их название поперечнополосатые.
B скелетной мышце выделяют сухожильную головку, которой мышца начинается на кости, мышечное брюшко, состоящее из волокон, и сухожильный хвост, которым мышца заканчивается на другой кости (рис. 1).
Мышечное волокно - структурная единица мышцы. Известны три типа мышечных волокон: белые быстро сокращающиеся (VT), промежуточные (FR) и медленно сокращающиеся (ST). Биохимически они различаются механизмами энергетического обеспечения мышечного сокращения. Их иннервируют разные мотонейроны, чем обусловлены неодновременность включения в работу и различная скорость сокращения волокон. Разные мышцы имеют разное сочетание типов волокон.

Рис. 1. Мышца
Каждая мышца состоит из нескольких тысяч мышечных волокон, объединяемых соединительными прослойками и такой же оболочкой. Мышца представляет собой многокомпонентный комплекс. Чтобы разобраться в строении мышцы следует изучить все уровни ее организации и структуры, входящие в ее состав (схема 1).
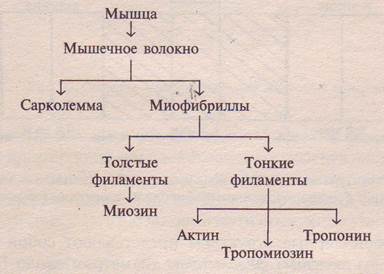
Схема 1. Уровни структурной организации мышцы
Строение мышечного волокна. Мышечные волокна построены из продольно расположенных миофибрилл диаметром около 1 мкм, в которых видны чередующиеся темные и светлые диски. Темные диски обладают двойным лучепреломлением и называются А-(анизотропными) дисками; светлые диски, необладающие двойным лучепреломлением, называются I-(изотропными) дисками (рис. 2). В середине диска I расположена плотная линия Z, которая пронизывает все волокно, как бы удерживая миофибриллы в пучке и одновременно упорядочивая расположение А- и I-дисков многих миофибрилл. Пучок миофибрилл от одной до другой Z-линии называется саркомером. Диски А имеют в середине более светлую полосу - зону Н, пересекаемую более темной М-зоной. В одной миофибрилле может содержаться до 1000-1200 саркомеров. Каждый саркомер включает: 1) сеть поперечных трубочек, ориентированных под углом 90° к продольной оси волокна и соединяющихся с наружной поверхностью клетки; 2) саркоплазматический ретикулум, составляющий 8-10% объема клетки; 3) несколько митохондрий.

Рис. 2. Структура мышцы на разных уровнях организации: а – мышечное волокно; б – расположение миофибриллы в покоящейся мышце
Миофибриллярные структуры представляют собой агрегаты, состоящие из толстых филаментов диаметром около 14 нм и из расположенных между ними тонких филаментов диаметром 7-8 нм. Филаменты располагаются таким образом, что тонкие входят своими концами в промежутки между толстыми. Диски I состоят только из тонких филаментов, а диски А- из филаментов двух типов. Зона Н содержит только толстые филаменты, линия Z скрепляет тонкие филаменты между собой. Между толстыми и тонкими филаментами расположены поперечные мостики (спайки) толщиной около 3 нм, расстояние между этими мостиками 40 нм.
Толстые филаменты состоят из белка миозина. Общая структура миозина показана на рисунке 3. Палочковидная молекула миозина состоит из двух идентичных основных цепей (по 200 кДа) и четырех легких цепей (по 20 кДа), общая масса миозина около 500 кДа. Миозин состоит из глобулярной, образующей две головки, части, присоединенной к очень длинному стержню. Стержень представляет собой двухцепочечную а-спирализованную суперспираль.
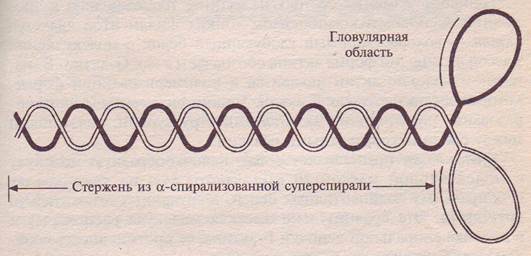
Рис. 3. Схематичное изображение молекулы миозина
Молекулы миозина объединяются, образуя филаменты, состоящие примерно из 400 палочковидных молекул, связанных друг с другом таким образом, что пары головок миозиновых молекул ложатся на расстоянии 14,3 нм друг от друга; они располагаются по спирали (рис. 4). Миозиновые нити стыкуются «хвост к хвосту».
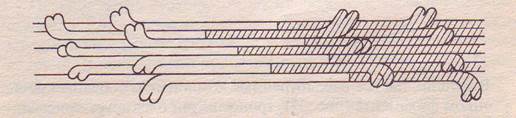
Рис. 4 . Упаковка миозиновых молекул при образовании толстого филамента
Миозин выполняет три биологически важные функции:
• При физиологических значениях ионной силы и рН молекулы миозина спонтанно образуют волокно.
• Миозин обладает каталитической активностью, т. e. является ферментом. В 1939 г. В.А. Энгельгардт и М.Н. Любимова обнаружили, что миозин способен катализировать гидролиз АТФ. Эта реакция является непосредственным источником свободной энергии, необходимой для мышечного сокращения.
• Миозин связывает полимеризованную форму актина - основного белкового компонента тонких миофибрилл. Именно это взаимодействие, как будет показано ниже, играет ключевую роль в мышечном сокращении.
Тонкие филаменты состоят из актина, тропомиозина и тропонина. Основным компонентом тонких филаментов является актин - водорастворимый глобулярный белок с молекулярной массой 42 кДа; эта форма актина обозначается как G-актин. В мышечном волокне актин находится в полимеризованной форме, которая обозначается как F-актин. Тонкие филаменты мышцы образованы двунитчатыми актиновыми структурами, связанными между собой нековалентными связями.
Тропомиозин представляет собой палочкообразную молекулу с молекулярной массой 70 кДа, состоящую из двух разных a-спиральных полипептидных цепей, закрученных относительно друг друга. Эта сравнительно жесткая молекула располагается в желобке спиральной цепочки F-актина; ее протяженность соответствует 7 G-актиновым мономерам.
Третий компонент тонких филаментов - тропонин (Тн), молекулярная масса которого около 76 кДа. Он представляет собой сферическую молекулу, состоящую из трех разных субъединиц, получивших название в соответствии с выполняемыми функциями: тропомиозинсвязывающей (Тн-Т), ингибирующей (Тн-I) и кальцийсвязывающей (Тн-С). Каждый компонент тонких филаментов соединяется с двумя другими нековалентными связями:
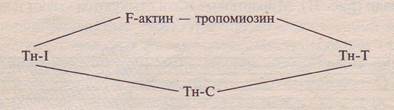
B мышце, где все рассмотренные компоненты собраны вместе в тонком филаменте (рис. 5), тропомиозин блокирует присоединение миозиновой головки к находящемуся рядом F-актиновому мономеру. Кальций, связываясь с Тн-С, значительно изменяет конформацию белка, увеличивая степень взаимодействия между субъединицами тропонина и одновременно ослабляя связь между Тн-I и F-актином. Это приводит к перемещению молекулы тропомиозина по желобку тонкого филамента. Результатом такого движения является открытие миозинсвязывающего центра на поверхности актина.

Рис. 5. Взаиморасположение тропомиозина, тропонина и актина в тонком филаменте мышцы
Актив-тропомиозин-тропонинмиозиновый комплекс характеризуется как Са 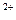 , Mg
, Mg 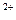 -АТФаза.
-АТФаза.
Рассмотрев сократительные элементы мышцы, перейдем к изучению других элементов, которые выполняют важные функции в мышечном сокращении.
Мышечное волокно состоит из клеток, окруженных электровозбудимой мембраной - сарколеммой, которая, как и любая другая мембрана, имеет липопротеиновую природу (толщина бимолекулярного слоя около 10 нм). Сарколемма отгораживает внутреннее содержимое мышечного волокна от межклеточной жидкости. Подобно другим мембранам, сарколемма имеет избирательную проницаемость для различных веществ. Через нее не проходят высокомолекулярные вещества (белки, полисахариды и др.), но проходят глюкоза, молочная и пировиноградная кислоты, кетоновые тела, аминокислоты и короткие пептиды.
Перенос через сарколемму носит активный характер (осуществляется с помощью посредников), что позволяет накапливать внутри клетки некоторые вещества в большей концентрации, чем снаружи. Избирательная проницаемость сарколеммы играет большую роль в возникновении возбуждения в мышечном волокне. Сарколемма проницаема для катионов калия, которые накапливаются внутри мышечного волокна. В то же время она содержит «ионный насос», выводящий из клетки катионы натрия. Концентрация катионов натрия в межклеточной жидкости выше, чем концентрация катионов калия внутри клетки; кроме того, во внутренних зонах волокна содержится значительное количество органических анионов. Все это приводит к возникновению на наружной поверхности сарколеммы избытка положительных, а на внутренней - отрицательных зарядов. Разность зарядов приводит к возникновению мембранного потенциала, который в состоянии покоя мышечного волокна равен 90-100 мВ и является необходимым условием возникновения и проведения возбуждения.
Внутриклеточная жидкость называется саркоплазмой. В саркоплазме локализованы органические вещества, минеральные соли, а также субклеточные частицы: ядра, митохондрии, рибосомы, функция которых заключается в регуляции обмена веществ в мышечном волокне путем воздействия на синтез специфических мышечных белков.
Внутри саркоплазмы находится система продольных и поперечных трубочек, мембран, пузырьков, носящая название саркоплазматический ретикулум (SR). Толщина мембран SR около 6 нм. Саркоплазматический ретикулум делит саркоплазму на отдельные отсеки, в которых протекают различные биохимические процессы. Пузырьки и трубочки оплетают каждую миофибриллу. Через трубочки, связанные с наружной клеточной мембраной, возможен прямой обмен веществами между клеточными органеллами и межклеточной жидкостью. Трубочки могут служить и для распространения волны возбуждения от наружной мембраны волокна к внутренним его зонам. Мембраны пузырьков, прилегающих к миофибриллам, содержат белки, связывающие катионы кальция.
Значение саркоплазматического ретикулума очень велико. Он связан непосредственно с сокращением и расслаблением мышцы, регулируя освобождение катионов кальция в мышечном волокне. Кроме того, к части саркоплазматического ретикулума прикреплены рибосомы, назначением которых является синтез белков. B той части ретикулума, где нет рибосом, синтезируется ряд необходимых мышечному волокну веществ: липидов, кликогена.
Одним из важнейших структурных компонентов мышечного
волокна являются митохондрии. Число митохондрий в мышечном
волокне очень велико, и располагаются они цепочками вдоль миофибрилл, тесно прилегая к мембранам ретикулума.
Как и у всякой клетки (оговоримся, что применение этого термина к мышечному волокну не совсем корректно), у мышечного волокна есть ядра, которые располагаются под сарколеммой. Ядро отделено от саркоплазмы двумя мембранами, одну из которых (внутреннюю) можно назвать ядерной, а вторая (наружная) является оболочкой ядра, переходящей в мембрану ретикулума. Пространство между этими двумя мембранами сообщается с канальцами саркоплазматического ретикулума. Внутри ядра находится ядрышко и хроматин. B состав хроматина входит ДНК, белки и низкомолекулярные РНК. В ДНК закодирована информация о структуре всех белков, синтезируемых в мышечном волокне.
B мышечном волокне есть и лизосомы, в которых локализованы гидролитические ферменты, расщепляющие белки, липиды и полисахариды. При очень интенсивной мышечной работе происходит нарушение мембран лизосом (либо увеличение их проницаемости) и в саркоплазму выходят ферменты, расщепляющие локализовaнные в ней биополимеры. Но это явление - не дисфункция.
Дата добавления: 2015-07-07; просмотров: 1463;
