Теплоемкость газа
Кроме параметров состояния газа (р, w, и Т) большую роль в термодинамических процессах играет физическая величина, называемая теплоемкостью. Теплоемкость газа представляет собой количество тепла – q, сообщаемое единице веса газа в данном процессе при изменении его температуры на 1 ºС. Как видно из определения, характер процесса оказывает существенное влияние на величину теплоемкости. Теплоемкость – С измеряется в ккал/кг·град. Различают истинную и среднюю теплоемкость.
Истинная теплоемкость
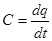
где: q – количество тепла;
t – температура газа в ºС, соответствует бесконечно малому изменению температуры газа в ходе конкретного термодинамического процесса. Теплоемкость газа существенно зависит от температуры. Для пороховых газов зависимостью теплоемкости от давления пренебрегают. В диапазоне температур 2000 – 3500 ºС. Теплоемкость можно принять изменяющуюся от температуры по линейному закону.
С = а + вt º
Где а и в – числовые коэффициенты, зависящие от физико-химических свойств газа и характера протекающего в нем термодинамического процесса.
Средняя теплоемкость - 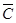 - среднее значение в диапазоне температур t1º и t2º, которое определяется из соотношения
- среднее значение в диапазоне температур t1º и t2º, которое определяется из соотношения
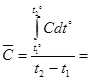
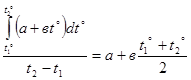 (2.13.)
(2.13.)
В термодинамических расчетах широко применяются теплоемкости изохорного (Сw) и изобарного (Ср) процессов, а также отношение этих теплоемкостей
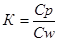
Коэффициент К называется показателем адиабаты. Для идеальных газов К является величиной, зависящей лишь от числа степеней свободы. По данным кинетической теории для одноатомных газов 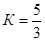 , для двухатомных
, для двухатомных 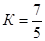 , для трехатомных
, для трехатомных  .
.
В баллистике чаще применяется разность между К и 1 и обозначается буквой θ
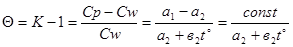
Величины К и θ являются функциями температуры. Значение Q убывает с увеличением температуры.
Из физики известно, что μ Ср - μ Сw = А·Rμ= 2
Где μ С – молярная теплоемкость, ккал/кмоль·град
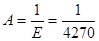
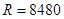
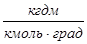
Для смеси газов теплоемкость C определяется по формуле (2.14.)
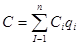 (2.14.)
(2.14.)
где: Сi – теплоемкость i-го компонента смеси;
qi – весовая доля i-го компонента смеси.
Дата добавления: 2015-07-06; просмотров: 1376;
