В отличие от иммуносупрессии иммунологическая толерантность предполагает изначальную ареактивность иммунокомпетентных клеток к определенному антигену.
Вопросы к занятию.
1.Определение понятия трансплантация. Виды трансплантации в зависимости от генетической чужеродности антигена.
2. Иммунологическая характеристика трансплантата.
3. Основные механизмы трансплантационного иммунитета.
4. Характеристика прямого и непрямого механизмов распознавания Т-лимфоцитами МНС-молекул трансплантата в рамках клеточного адаптивного иммунного ответа.
5. Значение NK-клеток при распознавании трансплантата.
6. Гуморальный адаптивный иммунный ответ и нормальные антитела при отторжении трансплантата.
7. Иммунологические основы сверхострого, острого и отсроченного отторжения трансплантата.
8. Трансплантация костного мозга. Реакция «трансплантат против хозяина».
9. Иммунологическая толерантность, определение, классификации, механизмы формирования.
Трансплантационный иммунитет. Иммунологическая толерантность
Трансплантацией называют пересадку тканей или органов, хирургически изъятых из одного организма (донора), во внутреннюю среду другого организма (реципиента).
Если трансплантацию делают между генетически чужеродными организмами одного вида, то ее называют аллотрансплантацией, а антигены тканей — аллоатигенами, реакцию иммунной системы — соответственно ответом на аллоантигены. Разных видов – ксеногенная. Пересадка от самого реципиента – аутотрансплантация. От генетически идентичных доноров (однояйцовые близнецы).
Наибольшую роль в отторжении трансплантата играют антигены МНС II класса, вызывающие преимущественно Т-кл иммунитет.
Трансплантации тканей — ятрогенное действие, не имеющее естественных аналогов в природе. Тем не менее в медицинских целях трансплантацию производят не так уж редко.
Трансплантационный иммунитет.
С иммунологической точки зрения трансплантат содержит – собственный клетки органа донора с чужим МНСI (это чужеродный белок, который при слущивании, распознается дендритными клетками реципиента и рецептор, с которым СD8 лимфоциты реципиента могут взаимодействовать как с измененным своим) + дендритные клетки донора с чужим МНСI.
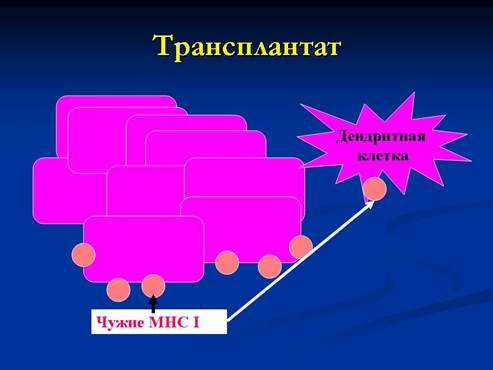
Трансплантационная реакция сочетает некоторые черты цитотоксической и воспалительной форм клеточного иммунного ответа. Она реализуется с участием как CD8+, так и CD4+ Т-лимфоцитов. Первые являются основными эффекторными клетками, ответственными за гибель клеток трансплантата; вторые обеспечивают развитие иммунного воспаления, способствующего гибели пересаженной ткани через нарушение трофики и активацию факторов врожденного иммунитета.
Афферентное звено иммунного ответа на аллотрансплантат состоит из двух параллельных путей, приводящих к активации CD4+ и CD8+ Т-лимфоцитов. Вовлечение в ответ CD4+ Т-клеток происходит за счет миграции из трансплантата в региональный лимфатический узел дендритных клеток. Известен феномен «клеток-пассажиров»: для того, чтобы аллогенный трансплантат был распознан иммунной системой хозяина, в нем должны присутствовать клетки костномозгового происхождения, при искусственном вымывании которых трансплантат утрачивает иммуногенность.
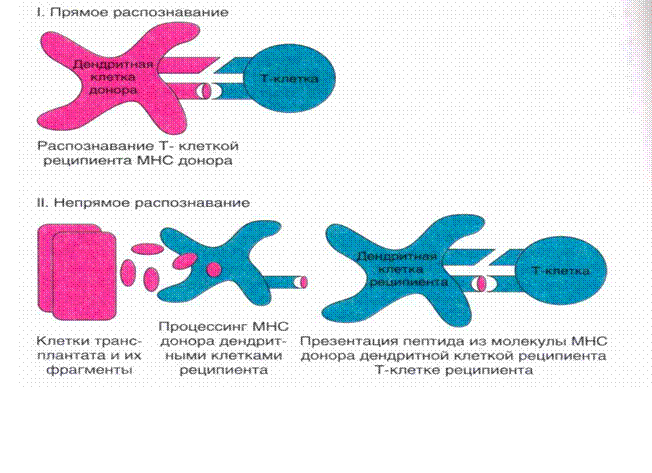
Показано, что.Т-клетки могут распознавать молекулы МНС с помошью двух разных механизмов — прямого и непрямого, опосредованного через презентацию аутологичными АПК. В последнем случае презентация реализуется по классическому пути: молекула МНС вместе с другими молекулами аллогенных клеток поступает в дендритные клетки путем эндоцитоза, расщепляется в их эндосомах и включается в состав молекул МНС-II. Такой путь презентации обычно реализуется при активации CD4+Т-лимфоцитов. В соответствии с основными закономерностями развития иммунного ответа этот процесс реализуется в региональном лимфатическом узле, в который мигрируют из трансплантата содержащиеся в нем дендритные клетки («клетки-пассажиры»). Вероятно, именно они служат источником донорских молекул МНС.
Прямое распознавание МНС-антигенов чаще реализуется при активации CD8+ Т-клеток. В этом случае TCR непосредственно взаимодействует с аллогенной молекулой МНС. Вероятно, источником антигенного сигнала служит клетка-пассажир — аллогенная дендритная клетка, которая сама представляет молекулу МНС класса I Т-лимфоциту реципиента. Полагают, что в этом процессе основную роль играет распознавание не антигенного пептида (вероятно, он вообще не имеет значения), а особенностей структуры молекулы МНС, отличающейся от МНС хозяина. Очевидно, аллогенная дендритная клетка, как и сингенная, поставляет костимулирующие сигналы.
 |
Формирующиеся эффекторные Т-клетки обоих типов (Thl-клетки и цитототоксические Т-лимфоциты) поступают в циркуляцию и в результате экспрессии на их поверхности хемокиновых рецепторов, мигрируют в очаги воспаления, всегда сопутствующего трансплантации, и инициируют реакции, приводящие к отторжению ткани.
Наряду с этими антигенспецифическими клетками в трансплантат мигрируют естественные киллеры- обусловлено отсутствием на клетках мишенях сингенных молекул МНСI, а также воспалительные клетки, прежде всего макрофаги.
Цитотоксические клетки обоих типов осуществляют цитолиз по перфориновому и Fas-зависимому механизмам. Дополнительный вклад в отторжение аллотрансплантатов вносит IFNy, выделяемый цитотоксическими клетками обоих типов.
Еще П. Медавар показал, что гуморальные антитела не играют существенной роли в отторжении аллотраснплантата. В некоторых ситуациях антитела даже препятствуют отторжению, защищая клетки трансплантата от разрушительного действия Т-лимфоцитов. При повторной подсадке аллогенных тканей антитела, образующиеся в ходе иммунного ответа на аллоантигены, вносят вклад в реакцию отторжения. Они могут диффундировать в трансплантат, формировать иммунные комплексы с мембранными антигенами его клеток, привлекая макрофаги и обусловливая их FcR-зави-симую активацию.
Нормальные антитела. При пересадке ксенотрансплантатов антитела могут играть ключевую роль в отторжении. Однако это не иммунные, а естественные антитела к а-гликановым гликаны) входят в состав мембранных гликопро-теинов клеток большинства животных, но отсутствуют у человека. В результате развивается быстрая реакция, сопровождающаяся спазмом сосудов, напоминающая реакцию secondset на аллотрансплантат.
Лимфоидная инфильтрация — одно из самых типичных морфологических проявлений трансплантационной реакции.
Отторжение трансплантата с клинической точки зрения бывает:
1) сверхострое — на операционном столе;
2) острое— в течение первых месяцев после пересадки;
3) отсроченное— через несколько лет после пересадки.
Сверхострое отторжение происходит во время или вскоре после операции. При этом развивается окклюзия кровеносных сосудов, связывающих трансплантат с телом. Это случается, если организм реципиента уже был иммунизирован антигенами донора или антигенами, перекрестно реагирующими с антигенами донора, и у реципиента в крови есть достаточное количество антител к тканевым антигенам стенок сосудов или клеток крови донора. Эти антитела немедленно «садятся» на стенки сосудов трансплантата, активируют комплемент и систему коагуляции крови, что влечет за собой быстрый тромбоз сосудов и отключение органа.
Острое отторжение — это нормальный первичный иммунный ответ на трансплантат при отсутствии медикаментозной иммуносупрессии. В деструкцию трансплантата могут быть вовлечены все известные эффекторные механизмы иммунного воспаления.
Отсроченное отторжениепо механизмам аналогично острому, но только в результате эффективной иммуносупрессии индукция иммунного ответа откладывается на несколько лет.
Трансплантация костного мозга. Реакция «трансплантат против хозяина»
Пересадки клеток костного мозга занимают обособленное место в практике трансплантаций. Во-первых, их осуществляют в форме инфузий суспензий клеток, а не подсадки солидной ткани. Во-вторых, при пересадке аллогенного костного мозга мобилизуются иммунные механизмы, отличные от таковых при трансплантации солидных органов. В-третьих, подобная трансплантация несет опасность иммунологической агрессии со стороны пересаженной ткани.
Трансплантация аллогенного костного мозга, содержащего Т-лимфоциты, может послужить основой для возникновения реакции «трансплантат против хозяина» (РТПХ).
Острая болезнь «трансплантат против хозяина» развивается в течение 100 сут после облучения и пересадки костного мозга.
Чаще всего наблюдается поражение трех «мишеней» — кожи (эпидермиса), печени (эпителия желчных протоков, но не гепатоцитов) и пищеварительного тракта (слизистой оболочки). Проявлениями РТПХ в этом случае являются сыпь, желтуха, диарея, кишечные кровоизлияния. Массивное слущивание эпителия слизистой оболочки кишечника или обширные некротические процессы могут приводить к смертельному исходу.
Хроническая болезнь «трансплантат против хозяина» развивается позже 100 сут после подсадки костного мозга. Она проявляется фиброзом и атро-фическими процессами без некрозов. Поражаются те же эпителиальные ткани и органы, что и при острой форме болезни, а также легкие.
Общепринятый подход к профилактике болезни «трансплантат против хозяина» состоит в удалении Т-клеток из пересаживаемого костного мозга. Это действительно предотвращает развитие заболевания, но при этом ухудшается приживление трансплантируемых клеток в костном мозгу реципиента.
В тактике клинической трансплантации решающую роль играют две процедуры — подбор доноров трансплантатов и иммуносупрессия.
Обычный материал для пересадок — органы, полученные непосредственно после смерти (чаще всего при несчастных случаях) или криоконсер-вированные органы. Существуют межнациональные банки органов, и при необходимости пересадки на основании анализа баз данных подбирают донора с максимальной совместимостью. При этом учитывают антигены полиморфных локусов HLA - DRB, DQA, DQB, DPA, DPB, А, В, С. Решающее значение для успеха трансплантации имеет совместимость по генам HLA класса II, особенно DRB. Среди продуктов генов HLA класса I наибольшее значение имеют антигены HLA-B. Показано, что при полной совместимости по генам DR и В и адекватной иммуносупрессии приживление донорской почки в течение года происходит в 90% случаев, тогда как при максимальной несовместимости по этим генам (различия по 4 аллелям) и такой же супрессивной терапии — в 70% случаев
Переливание крови
Особым вариант пересадки аллогенных тканей — переливание крови. Эта процедура получила широкое применение в медицинской практике после открытия К. Ландштейнером (К. Landsteiner) в 1900 г. групп крови — первых установленных систем антигенного полиморфизма у человека.
Эритроциты не имеют МНСI.
| Группа крови | Генотип | Эритроцитарный антиген | Естественные антитела |
| 0(1) | h/h | Н | Анти-А (а), анти-В |
| А(Н) | А/А, A/h | А | Анти-В |
| В(Ш) | В/В, B/h | В | Анти-А (а) |
| AB(IV) | А/В | А, В | Нет |
Особенность системы аллоантигенов, важная при переливании крови, состоит в уже упомянутом наличии в сыворотке крови людей естественных антител к отсутствующим антигенам - А и В при I группе крови В при II группе крови и А при III группе крови; при IV группе крови естественные антитела отсутствуют. Эти антитела относятся к изотипу IgM. Вероятно, они являются продуктами В1-клеток. Антигрупповые антитела называют изоаглютининами и обозначают греческими буквами, соответствующими латинским обозначениям антигенов, которые они распознают, например изоаглютинин а — это анти-А-анти-тела. Реакцию аглютинации используют для определения групп крови. В присутствии комплемента антигрупповые антитела вызывают лизис анти-генположительных эритроцитов.
Таким образом, наличие у реципиента предсуществующих антител к антигенам донора приводит к лизису перелитых эритроцитов и формированию иммунных комплексов, содержащих антитела и фрагменты мембраны эритроцитов.
Поскольку количество вводимой крови, как правило, значительно меньше ее общего объема у реципиента, ее аглютинирующая способность, как правило, нивелируется. Именно поэтому наличие в переливаемой крови антител к эритроцитарным антигенам хозяина обычно не вызывает патологических последствий. Раньше на этом основании формулировали правила переливания крови, в соответствии с которыми лиц с I группой крови рассматривали как универсальных доноров, а лиц с IV группой — как универсальных реципиентов. В настоящее время общепринята практика, допускающая переливание крови только при полной совместимости донора и реципиента по антигенам системы АВО.
Наиболее защищенным от иммунной атаки «трансплантатом» является плод в матке беременной женщины.
Иммунологическая толерантность— явление, противоположное иммунному ответу и иммунологической памяти. Проявляется она отсутствием специфического продуктивного иммунного ответа организма на антиген в связи с неспособностью его распознавания.
В отличие от иммуносупрессии иммунологическая толерантность предполагает изначальную ареактивность иммунокомпетентных клеток к определенному антигену.
Иммунологическую толерантность вызывают антигены, которые получили название толерогены.Ими могут быть практически все вещества, однако наибольшей толерогенностью обладают полисахариды.
Иммунологическая толерантность бывает:
1.врожденной
2.приобретенной.
Примером врожденной толерантностиявляется отсутствие редакции иммунной системы на свои собственные антигены.
Приобретенную толерантность можно создать, вводя в организм вещества, подавляющие иммунитет (иммунодепрессанты), или же путем введения антигена в эмбриональном периоде или в первые дни после рождения индивидуума.
Приобретенная толерантность может быть:
1.активной
2.пассивной.
Активная толерантностьсоздается путем введения в организм толерогена, который формирует специфическую толерантность.
Пассивную толерантностьможно вызвать веществами, тормозящими биосинтетическую или пролиферативную активность иммунокомпетентных клеток (антилимфоцитарная сыворотка, цитостатики и пр.).
Иммунологическая толерантность отличается специфичностью — она направлена к строго определенным антигенам.
По степени распространенности различают:
1.поливалентную
2.расщепленную толерантность.
Поливалентная толерантностьвозникает одновременно на все антигенные детерминанты, входящие в состав конкретного антигена.
Для расщепленной, или моновалентной, толерантности характерна избирательная невосприимчивость каких-то отдельных антигенных детерминант.
Степень проявления иммунологической толерантности существенно зависит от ряда свойств макроорганизмаитолерогена. Так, на проявление толерантности влияет:
1.возраст
2.состояние иммунореактивности организма.
Иммунологическую толерантность легче индуцировать в эмбриональном периоде развития и в первые дни после рождения, лучше всего она проявляется у животных со сниженной иммунореактивностью и с определенным генотипом.
Из особенностей антигена, которые определяют успешность индукции иммунологической толерантности, нужно отметить степень его чужеродности для организма и природу, дозу препарата и продолжительность воздействия антигена на организм. Наибольшей толерогенностью обладают наименее чужеродные по отношению к организму антигены, имеющие малуюмолекулярную массу и высокую гомогенность. Легче всего формируется толерантность на тимуснезависимые антигены, например, бактериальные полисахариды.
Важное значение в индукции иммунологической толерантности имеют:
1.доза антигена
2.продолжительность его воздействия.
Различают толерантность:
1.высокодозовую
2.низкодозовую
Высокодозовую толерантностьвызывают введением больших количеств высококонцентрированного антигена. При этом наблюдается прямая зависимость между дозой вещества и производимым им эффектом.
Низкодозовая толерантность, наоборот, вызывается очень малым количеством высокогомогенного молекулярного антигена. Соотношение «доза-эффект» в этом случае имеет обратную зависимость.
В эксперименте толерантность возникает через несколько дней, а иногда часов после введения толерогена и, как правило, проявляется в течение всего времени, пока он циркулирует в организме. Эффект ослабевает или прекращается с удалением из организма толерогена. Обычно иммунологическая толерантность наблюдается непродолжительный срок — всего несколько дней. Для ее пролонгирования необходимы повторные инъекции препарата.
Механизмы толерантности многообразны и до конца не расшифрованы. Известно, что ее основу составляют нормальные процессы регуляции иммунной системы.
Выделяют три наиболее вероятные причины развития иммунологической толерантности:
1. Элиминация из организма антигенспецифических клонов лимфоцитов.
2. Блокада биологической активности иммунокомпетентных клеток.
3. Быстрая нейтрализация антигена антителами.
Элиминации, или делеции подвергаются, как правило, клоны аутореактивных Т- и В-лимфоцитов на ранних стадиях их онтогенеза. Активация антигенспецифического рецептора (TCR или BCR) незрелого лимфоцита индуцирует в нем апоптоз. Этот феномен, обеспечивающий в организме ареактивность к аутоантигенам, получил название центральной толерантности.
Основная роль в блокаде биологической активности иммунокомпетентных клеток принадлежит иммуноцитокинам. Воздействуя на соответствующие рецепторы, они способны вызвать ряд «негативных» эффектов. Например, пролиферацию Т- и В-лимфоцитов активно тормозит 3-ТФР. Дифференцировку ТО-хелпера в Т1 можно заблокировать при помощи ИЛ-4, -13, а в Т2-хелпер — у-ИФН. Биологическая активность макрофагов ингибируется продуктами Т2-хелпе-ров (ИЛ-4, -10, -13, (3-ТФР и др.).
Биосинтез в В-лимфоците и его превращение в плазмоцит подавляется IgG. Быстрая инактивация молекул антигена антителами предотвращает их связывание с рецепторами иммунокомпетентных клеток — элиминируется специфический активирующий фактор.
Возможен адаптивный перенос иммунологической толерантности интактному животному путем введения ему иммунокомпетентных клеток, взятых от донора. Толерантность можно также искусственно отменить:
1.Для этого необходимо активировать иммунную систему адъювантами, интерлейкинами или переключить направленность ее реакции иммунизацией модифицированными антигенами.
2.Другой путь — удалить из организма толероген, сделав инъекцию специфических антител или проведя иммуносорбцию.
Феномен иммунологической толерантности имеет большое практическое значение. Он используется для решения многих важных проблем медицины, таких как пересадка органов и тканей, подавление аутоиммунных реакций, лечение аллергий и других патологических состояний, связанных с агрессивным поведением иммунной системы.
| <== предыдущая лекция | | | следующая лекция ==> |
| МЕХАНИЗМЫ ЗАЖИМА ЗАГОТОВОК | | | Лекция №1. 1.Выбор оптимального оборудования из существующего ряда для проектирования новой технологии. |
Дата добавления: 2015-08-01; просмотров: 2095;
